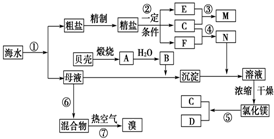
题目内容
某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
(1)配制待测液:称取4.1g固体烧碱样品(杂质不与酸反应)配制成250mL溶液,需要的主要仪器有 .
(2)滴定①用 量取10.00mL待测液.②向锥形瓶中加入几滴酚酞,用0.2010mol?L-1标准盐酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视 ,直到 时停止滴定.
(1)配制待测液:称取4.1g固体烧碱样品(杂质不与酸反应)配制成250mL溶液,需要的主要仪器有
(2)滴定①用
考点:中和滴定
专题:实验题
分析:(1)根据实验操作过程选取实验仪器;
(2)①根据碱性溶液盛放在碱式滴定管中;
②根据滴定时,两眼注视锥形瓶中溶液颜色的变化;溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(2)①根据碱性溶液盛放在碱式滴定管中;
②根据滴定时,两眼注视锥形瓶中溶液颜色的变化;溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
解答:
解:(1)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器是:托盘天平、药匙、玻璃棒、250mL容量瓶、胶头滴管;
故答案为:托盘天平、药匙、玻璃棒、250mL容量瓶、胶头滴管;
(2)①待测液是碱性溶液,应盛放在碱式滴定管中,通过滴定管量取10.00mL待测液,
故答案为:碱式滴定管;
②滴定时,两眼注视锥形瓶中溶液颜色的变化,以便准确判断终点的到达;滴定时,当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色;
故答案为:锥形瓶中溶液颜色的变化;溶液由红色变为无色,且半分钟内不褪色;
故答案为:托盘天平、药匙、玻璃棒、250mL容量瓶、胶头滴管;
(2)①待测液是碱性溶液,应盛放在碱式滴定管中,通过滴定管量取10.00mL待测液,
故答案为:碱式滴定管;
②滴定时,两眼注视锥形瓶中溶液颜色的变化,以便准确判断终点的到达;滴定时,当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色;
故答案为:锥形瓶中溶液颜色的变化;溶液由红色变为无色,且半分钟内不褪色;
点评:本题主要考查了酸碱中和滴定的操作,掌握中和滴定的原理是解题的关键,难度中等.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、含有NA个氦原子的氦气在标准状况下的体积约为11.2 L |
| B、在常温常压下,11.2 L Cl2含有的分子数约为0.5 NA |
| C、25℃,1.01×105Pa,64 g SO2中含有的原子数为3 NA |
| D、标准状况下,11.2 L H2O含有的分子数为0.5 NA |
下列化学用语正确的是( )
A、水的电子式: |
B、氯化钠的电子式: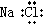 |
| C、KClO3的电离方程式:KClO3=K++Cl-+3O2- |
| D、碳酸氢钠的电离方程式:NaHCO3=Na++HCO3- |
下列物质转化关系中,必须加入适当氧化剂才能实现的是( )
| A、PCl3→PCl5 |
| B、MnO4-→Mn2+ |
| C、SO3→SO42- |
| D、CO2→CO |
近两年来,“雾霾”一直是人们所关注的对象,如图为雾霾的主要成分示意图.下列说法不正确的是( )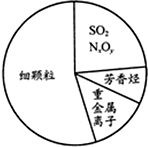

| A、苯是最简单的芳香烃 |
| B、重金属离子可导致蛋白质变性 |
| C、SO2和NxOy均属于酸性氧化物 |
| D、大量燃烧化石燃料是造成雾霾天气的一种重要因素 |