题目内容
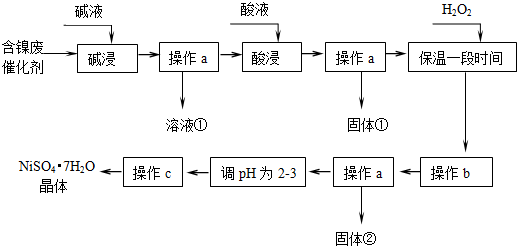
 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )| A、发生的反应可表示为:2A(g)?2B(g)+C(g) |
| B、前2 min A的分解速率为0.1mol?L-1?min-1 |
| C、开始时,正逆反应同时开始 |
| D、2 min时,A、B、C的浓度之比为2:3:1 |
考点:化学平衡的计算
专题:
分析:由图象可知,A的物质的量浓度减小,B和C的物质的量浓度增加,则A为反应物,B和C为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.2mol/L:0.1mol/L=2:2:1,则反应的化学方程式为2A?2B+C,根据v=
计算反应速率.
| △c |
| △t |
解答:
解:A、由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.2mol/L:0.1mol/L=2:2:1,则反应的化学方程式为2A?2B+C,故A正确;
B、由图可知前2 minA的△c(A)=0.2mol/L,所以v(C)=
=0.1 mol?L-1?min-1,故B正确;
C、由图象可知,A的物质的量浓度减小,B和C的物质的量浓度增加,则A为反应物,B和C为生成物,开始时从正反应开始,故C错误;
D、2 min时,A、B、C的浓度分别为:0.2mol/L、0.3mol/L、0.1mol/L,A、B、C的浓度之比为0.2mol/L:0.3mol/L:0.1mol/L=2:3:1,故D正确;
故选C.
B、由图可知前2 minA的△c(A)=0.2mol/L,所以v(C)=
| 0.2mol/L |
| 2min |
C、由图象可知,A的物质的量浓度减小,B和C的物质的量浓度增加,则A为反应物,B和C为生成物,开始时从正反应开始,故C错误;
D、2 min时,A、B、C的浓度分别为:0.2mol/L、0.3mol/L、0.1mol/L,A、B、C的浓度之比为0.2mol/L:0.3mol/L:0.1mol/L=2:3:1,故D正确;
故选C.
点评:本题考查化学平衡图象问题,题目难度不大,注意根据图象书写反应的化学方程式,计算速率、判断反应的方向.

练习册系列答案
相关题目
下列事实与胶体性质无关的是( )
| A、可用半透膜除去淀粉溶液中的少量NaCl |
| B、黄河入海口容易形成沙洲 |
| C、将植物油倒入水中用力搅拌可形成油水混合物 |
| D、一束平行光线通过蛋白质溶液,从侧面可以看到一条光亮的通路 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、含有NA个氦原子的氦气在标准状况下的体积约为11.2 L |
| B、在常温常压下,11.2 L Cl2含有的分子数约为0.5 NA |
| C、25℃,1.01×105Pa,64 g SO2中含有的原子数为3 NA |
| D、标准状况下,11.2 L H2O含有的分子数为0.5 NA |
 根据所给信息填空
根据所给信息填空