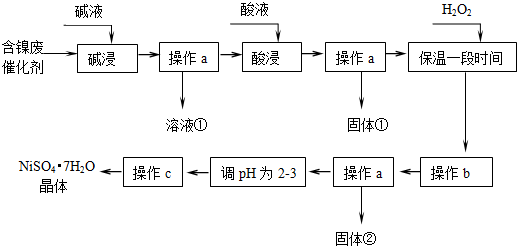
题目内容
实验室要制取Cl22.24L (标况下).
(1)写出相应的化学方程式.
(2)求出所需的MnO2质量和被氧化HCl在标况下的体积.(不考虑HCl的消耗).
(1)写出相应的化学方程式.
(2)求出所需的MnO2质量和被氧化HCl在标况下的体积.(不考虑HCl的消耗).
考点:化学方程式的有关计算
专题:计算题
分析:(1)实验室常用二氧化锰和浓盐酸反应制取氯气;
(2)根据方程式MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O 计算消耗MnO2的质量;被氧化的HCl生成Cl2,再根据Cl原子守恒计算.
(2)根据方程式MnO2+4HCl(浓)
| ||
解答:
解:(1)二氧化锰和浓盐酸反应生成氯化锰、氯气和水,反应的方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
答:生成氯气的反应方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)设制取的氯气为2.24L(标况下)需要MnO2的质量为x,则:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
87g 22.4L
x 2.24L
所以87g:x=22.4L:2.24L
解得x=8.7g;
被氧化的HCl生成Cl2,根据Cl原子守恒可知,被氧化的HCl的体积=2.24L×2=4.48L,
答:消耗MnO2的质量为8.7g,被氧化的HCl在标准状况下的体积为4.48L.
| ||
答:生成氯气的反应方程式为:MnO2+4HCl(浓)
| ||
(2)设制取的氯气为2.24L(标况下)需要MnO2的质量为x,则:
MnO2+4HCl(浓)
| ||
87g 22.4L
x 2.24L
所以87g:x=22.4L:2.24L
解得x=8.7g;
被氧化的HCl生成Cl2,根据Cl原子守恒可知,被氧化的HCl的体积=2.24L×2=4.48L,
答:消耗MnO2的质量为8.7g,被氧化的HCl在标准状况下的体积为4.48L.
点评:本题考查化学方程式有关计算、氧化还原反应的相关计算,注意(2)中结合化合价的变化利用原子守恒计算,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、含有NA个氦原子的氦气在标准状况下的体积约为11.2 L |
| B、在常温常压下,11.2 L Cl2含有的分子数约为0.5 NA |
| C、25℃,1.01×105Pa,64 g SO2中含有的原子数为3 NA |
| D、标准状况下,11.2 L H2O含有的分子数为0.5 NA |
在298K时,实验测得溶液中的反应:H2O2+2HI═2H2O+I2,在不同浓度时的化学反应速率见表,由此可推知当c(HI)=0.500mol?L-1,c(H2O2)=0.400mol?L-1时的反应速率为( )
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| c(HI)/mol?L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
| c(H2O2)/mol?L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
| v/mol?L-1?s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 | 0.0228 |
| A、0.0380 mol?L-1?s-1 |
| B、0.152 mol?L-1?s-1 |
| C、0.608 mol?L-1?s-1 |
| D、0.760 mol?L-1?s-1 |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )

| A、反应的化学方程式为:N?2M |
| B、t2时,正逆反应速率相等,达到平衡 |
| C、t3时,正反应速率大于逆反应速率 |
| D、t1时,N的浓度是M浓度的2倍 |