题目内容
某化合物甲是制备负载型催化剂的主要原料.也是一种有机反应很好的催化剂,具有工业生产价值,经组成分析化合物甲中含有四种元素.取8.74g化合物甲,加热到421°C以上使其完全分解,生成固体混合物5.74g(其成分不与水反应)和折合为标准状况下的气体混合物2.016L.将固体混合物溶于足量的水后过滤得红棕色滤渣乙和滤液丙.测得洗涤、干燥后的滤渣乙质量为1.60g,将乙溶于稀盐酸后滴加KSCN溶液呈血红色.取滤液丙进行焰色反应,透过蓝色钴玻璃观察到紫色火焰,滴加几滴BaCl2溶液,产生白色沉淀.气体混合物仅含两种元素,由丁和戊组成,其中丁占总体积的
,密度为1.25g?L-1.戊能使澄清石灰水变浑浊.
请回答以下问题:
(1)化合物甲的化学式为 ,戊的电子式为 .
(2)加热化合物甲使其完全分解的化学方程式为 .
(3)红棕色固体乙与气体丁反应的化学方程式为 .举一个物质乙在生活中的用途 .
(4)试判断化合物甲的水溶液中滴加KSCN溶液能否呈血红色,并说明理由 .
(5)设计一个实验方案,探究滤液丙中通入一定量的气体戊后的盐成份: .
| 2 |
| 3 |
请回答以下问题:
(1)化合物甲的化学式为
(2)加热化合物甲使其完全分解的化学方程式为
(3)红棕色固体乙与气体丁反应的化学方程式为
(4)试判断化合物甲的水溶液中滴加KSCN溶液能否呈血红色,并说明理由
(5)设计一个实验方案,探究滤液丙中通入一定量的气体戊后的盐成份:
考点:无机物的推断
专题:推断题
分析:化合物甲中含有四种元素.取8.74g化合物甲,加热到421°C以上使其完全分解,生成固体混合物5.74g(其成分不与水反应)和折合为标准状况下的气体混合物2.016L.
将固体混合物溶于足量的水后,过滤得红棕色滤渣乙和滤液丙.测得洗涤、干燥后的滤渣乙质量为1.60g,将乙溶于稀盐酸后滴加KSCN溶液呈血红色,则乙为Fe2O3,故甲中含有Fe元素,O元素;
取滤液丙进行焰色反应,透过蓝色钴玻璃观察到紫色火焰,则甲含有K元素;
气体混合物仅含两种元素,由丁和戊组成,其中丁占总体积的
,其密度为1.25g?L-1,丁气体相对分子质量=1.25×22.4=28,结合滤液丙滴加几滴BaCl2溶液,产生白色沉淀,戊能使澄清石灰水变浑浊,可推知气体丁为CO、戊为CO2,白色沉淀为BaCO3,则滤液丙为K2CO3,甲中含有C元素;
Fe2O3的物质的量=
=0.01mol,K2CO3的物质的量=
=0.03mol,混合气体总物质的量=
=0.09mol,则CO物质的量=0.09mol×
=0.06mol,CO2的物质的量=0.09mol-0.06mol=0.03mol,故甲中K、Fe、C、O原子数目之比=0.03×2:0.01×2:(0.03+0.09):(0.01×3+0.03×3+0.06+0.03×2)=3:1:6:12,故甲为K3FeC6O12,据此解答.
将固体混合物溶于足量的水后,过滤得红棕色滤渣乙和滤液丙.测得洗涤、干燥后的滤渣乙质量为1.60g,将乙溶于稀盐酸后滴加KSCN溶液呈血红色,则乙为Fe2O3,故甲中含有Fe元素,O元素;
取滤液丙进行焰色反应,透过蓝色钴玻璃观察到紫色火焰,则甲含有K元素;
气体混合物仅含两种元素,由丁和戊组成,其中丁占总体积的
| 2 |
| 3 |
Fe2O3的物质的量=
| 1.6g |
| 160g/mol |
| 5.74g-1.6g |
| 138g/mol |
| 2.016L |
| 22.4L/mol |
| 2 |
| 3 |
解答:
解:化合物甲中含有四种元素.取8.74g化合物甲,加热到421°C以上使其完全分解,生成固体混合物5.74g(其成分不与水反应)和折合为标准状况下的气体混合物2.016L.
将固体混合物溶于足量的水后,过滤得红棕色滤渣乙和滤液丙.测得洗涤、干燥后的滤渣乙质量为1.60g,将乙溶于稀盐酸后滴加KSCN溶液呈血红色,则乙为Fe2O3,故甲中含有Fe元素,O元素;
取滤液丙进行焰色反应,透过蓝色钴玻璃观察到紫色火焰,则甲含有K元素;
气体混合物仅含两种元素,由丁和戊组成,其中丁占总体积的
,其密度为1.25g?L-1,丁气体相对分子质量=1.25×22.4=28,结合滤液丙滴加几滴BaCl2溶液,产生白色沉淀,戊能使澄清石灰水变浑浊,可推知气体丁为CO、戊为CO2,白色沉淀为BaCO3,则滤液丙为K2CO3,甲中含有C元素;
Fe2O3的物质的量=
=0.01mol,K2CO3的物质的量=
=0.03mol,混合气体总物质的量=
=0.09mol,则CO物质的量=0.09mol×
=0.06mol,CO2的物质的量=0.09mol-0.06mol=0.03mol,故甲中K、Fe、C、O原子数目之比=0.03×2:0.01×2:(0.03+0.09):(0.01×3+0.03×3+0.06+0.03×2)=3:1:6:12,故甲为K3FeC6O12,
(1)由上述分析可知,甲的化学式为K3FeC6O12,戊为CO2,电子式为: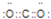 ,
,
故答案为:K3FeC6O12;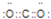 ;
;
(2)加热化合物甲使其完全分解的化学方程式为:2K3FeC6O12
3K2CO3+Fe2O3+6CO↑+3CO2↑,
故答案为:2K3FeC6O12
3K2CO3+Fe2O3+6CO↑+3CO2↑;
(3)红棕色固体乙与气体丁反应的化学方程式为:Fe2O3+3CO
2Fe+3CO2,物质乙在生活中的用途:颜料或炼铁原料等,
故答案为:Fe2O3+3CO
2Fe+3CO2;颜料或炼铁原料等;
(4)化合物甲的水溶液中滴加KSCN溶液能呈血红色,甲溶液中有铁离子,(或不能,铁离子和C2O42-形成稳定的[Fe(C2O4)3]3-)
故答案为:能,甲溶液中有铁离子(或不能,铁离子和C2O42-形成稳定的[Fe(C2O4)3]3-);
(5)可能是碳酸钾和碳酸氢钾的混合物或者只有碳酸氢钾,检验方法:取少量溶液于试管中,加少量氯化钡溶液,如果产物白色沉淀,则为两者的混合物,如不产生白色沉淀,则只有碳酸氢钾,
故答案为:取少量溶液于试管中,加少量氯化钡溶液,如果产物白色沉淀,则为两者的混合物,如不产生白色沉淀,则只有碳酸氢钾.
将固体混合物溶于足量的水后,过滤得红棕色滤渣乙和滤液丙.测得洗涤、干燥后的滤渣乙质量为1.60g,将乙溶于稀盐酸后滴加KSCN溶液呈血红色,则乙为Fe2O3,故甲中含有Fe元素,O元素;
取滤液丙进行焰色反应,透过蓝色钴玻璃观察到紫色火焰,则甲含有K元素;
气体混合物仅含两种元素,由丁和戊组成,其中丁占总体积的
| 2 |
| 3 |
Fe2O3的物质的量=
| 1.6g |
| 160g/mol |
| 5.74g-1.6g |
| 138g/mol |
| 2.016L |
| 22.4L/mol |
| 2 |
| 3 |
(1)由上述分析可知,甲的化学式为K3FeC6O12,戊为CO2,电子式为:
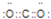 ,
,故答案为:K3FeC6O12;
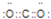 ;
;(2)加热化合物甲使其完全分解的化学方程式为:2K3FeC6O12
| ||
故答案为:2K3FeC6O12
| ||
(3)红棕色固体乙与气体丁反应的化学方程式为:Fe2O3+3CO
| ||
故答案为:Fe2O3+3CO
| ||
(4)化合物甲的水溶液中滴加KSCN溶液能呈血红色,甲溶液中有铁离子,(或不能,铁离子和C2O42-形成稳定的[Fe(C2O4)3]3-)
故答案为:能,甲溶液中有铁离子(或不能,铁离子和C2O42-形成稳定的[Fe(C2O4)3]3-);
(5)可能是碳酸钾和碳酸氢钾的混合物或者只有碳酸氢钾,检验方法:取少量溶液于试管中,加少量氯化钡溶液,如果产物白色沉淀,则为两者的混合物,如不产生白色沉淀,则只有碳酸氢钾,
故答案为:取少量溶液于试管中,加少量氯化钡溶液,如果产物白色沉淀,则为两者的混合物,如不产生白色沉淀,则只有碳酸氢钾.
点评:本题考查无机物推断,属于计算型推断,侧重考查元素化合物性质及计算推理能力,综合考查学生的分析解决问题能力,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列离子方程式错误的是( )
| A、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| B、向KI溶液中加H2SO4溶液后振摇:4H++4I-+O2═2I2+2H2O |
| C、酸性高锰酸钾中加入草酸,溶液褪色:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O |
| D、证明C的非金属性强于Si的反应:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,其氢化物中甲、乙、丙、丁、戊的化合价如下,下列说法正确的是( )
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A、乙的常见氧化物只有一种 |
| B、气态氢化物稳定性:丙>丁 |
| C、丙的氧化物能与戊的氢化物的水溶液反应 |
| D、原子半径大小:戊<丙 |

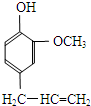 某有机化合物A因其具有麻醉作用,常用作局部麻醉剂和镇痛剂.它的结构简式如右图所示,请回答:
某有机化合物A因其具有麻醉作用,常用作局部麻醉剂和镇痛剂.它的结构简式如右图所示,请回答: 如图曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系.其中A点表示的单质是
如图曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系.其中A点表示的单质是