题目内容
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,其氢化物中甲、乙、丙、丁、戊的化合价如下,下列说法正确的是( )
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A、乙的常见氧化物只有一种 |
| B、气态氢化物稳定性:丙>丁 |
| C、丙的氧化物能与戊的氢化物的水溶液反应 |
| D、原子半径大小:戊<丙 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:短周期主族元素中,元素的最高正化合价与其族序数相等,最低负价=族序数-8,根据氢化物中甲、乙、丙、丁、戊的化合价知,甲、丙、丁、戊分别位于第IVA族、第IVA族、第VIA族、第VIIA族,乙的氢化物中显正化合价,说明该元素电负性小于H元素,为金属元素,位于第IA族,甲、乙、丙、丁、戊的原子序数依次增大,则甲、乙、丙、丁、戊的分别是C、Na、Si、S、Cl元素,再结合题目解答.
解答:
解:短周期主族元素中,元素的最高正化合价与其族序数相等,最低负价=族序数-8,根据氢化物中甲、乙、丙、丁、戊的化合价知,甲、丙、丁、戊分别位于第IVA族、第IVA族、第VIA族、第VIIA族,乙的氢化物中显正化合价,说明该元素电负性小于H元素,为金属元素,位于第IA族,甲、乙、丙、丁、戊的原子序数依次增大,则甲、乙、丙、丁、戊的分别是C、Na、Si、S、Cl元素,
A.乙是Na元素,乙的常见氧化物有Na2O、Na2O2,故A错误;
B.非金属性Si<Cl,所以气态氢化物稳定性:丙<丁,故B错误;
C.丙的氧化物是SiO2、戊的氢化物是HCl,二氧化硅属于酸性氧化物,和盐酸不反应,故C错误;
D.同一周期元素中,原子半径随着原子序数增大而减小,所以原子半径戊<丙,故D正确;
故选D.
A.乙是Na元素,乙的常见氧化物有Na2O、Na2O2,故A错误;
B.非金属性Si<Cl,所以气态氢化物稳定性:丙<丁,故B错误;
C.丙的氧化物是SiO2、戊的氢化物是HCl,二氧化硅属于酸性氧化物,和盐酸不反应,故C错误;
D.同一周期元素中,原子半径随着原子序数增大而减小,所以原子半径戊<丙,故D正确;
故选D.
点评:本题考查了原子结构和元素周期律,涉及物质的构成、元素周期律、物质的性质等知识点,同时考查学生对知识的灵活运用能力,注意二氧化硅不和强酸反应,但能和HF反应,为易错点.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
把99.5mL 0.2mol/L NaOH溶液加到100.5mL 0.1mol/L H2SO4中,所得溶液的pH为( )
| A、1 | B、2.7 | C、3 | D、3.3 |
化学与生产和生活密切相关,下列说法正确的是( )
| A、金属钠可以保存在煤油或酒精中,防止在空气中变质 |
| B、石油的裂化和煤的干馏,都属于化学变化 |
| C、等物质的量的乙烯和乙醇完全燃烧时所需氧气的质量相等 |
| D、聚氯乙烯制品易造成白色污染,可采用焚烧法处理 |
下列反应不属于加成反应的是( )
| A、CH2=CH2+H-OH→CH3-CH2-OH | ||
B、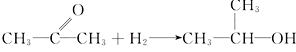 | ||
| C、CH3-CH=CH2+Br2→CH3CHBr→CH2Br | ||
D、N≡N+2H2
|
下列说法正确的是( )
| A、拉瓦锡发现质量守恒定律、卢瑟福发现电子、波尔提出氢原子模型都对化学学科的发展作出了重要贡献 |
| B、实验室制备少量氢氧化铝可用下列方法:往AlCl3溶液中加入稍过量的氨水,抽滤,得到胶状沉淀经洗涤、晾干 |
| C、核磁共振、红外光谱、紫外光谱和质谱仪,均可用于分析有机物的结构 |
| D、维生素、PLA、油脂、甲壳素、硝化纤维都是高分子化合物 |
 锌锰干电池中的二氧化锰主要来源于电解法生产.其装置如图所示,电解槽中间用只允许H+离子通过的氢离子交换膜隔开.两侧分别装有MnSO4溶液和稀硫酸,在一定的电压下通电电解.下列说法不正确的是( )
锌锰干电池中的二氧化锰主要来源于电解法生产.其装置如图所示,电解槽中间用只允许H+离子通过的氢离子交换膜隔开.两侧分别装有MnSO4溶液和稀硫酸,在一定的电压下通电电解.下列说法不正确的是( )| A、阳极的电极方程式:Mn2++2H2O-2e?═MnO2+4H+ |
| B、外电路中每通过0.2mol电子,阴极溶液中H+物质的量不变 |
| C、保持电流不变,升高温度,电极反应加快 |
| D、持续电解该溶液,阳极上可能会有氧气生成 |
 某班学生利用0.100mol?L-1的盐酸和0.100mol?L-1NaOH溶液反应测定酸碱滴定曲线.甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示:下列说法错误的是( )
某班学生利用0.100mol?L-1的盐酸和0.100mol?L-1NaOH溶液反应测定酸碱滴定曲线.甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示:下列说法错误的是( )| A、甲组同学滴定时选用的滴定管为酸式滴定管 |
| B、乙和丙两组同学的操作上都存在着失误 |
| C、乙组同学操作上的不足之处是在滴定终点附近测试和记录pH的间隔太大 |
| D、造成丙组同学的曲线与甲组同学不同的原因可能是用待装液润洗锥形瓶 |