题目内容
7.下列物质中属于碱的是( )| A. | KNO3 | B. | O3 | C. | Ca(OH)2 | D. | HNO3 |
分析 根据碱的定义及电离的离子的特点进行分析,电离时生成的阴离子都是氢氧根离子的化合物是碱.
解答 解:A、KNO3是钾离子和硝酸根离子构成的化合物,属于盐,故A错误;
B、臭氧属于单质,不属于碱,故B错误;
C、氢氧化钙是电离时生成的阴离子都是氢氧根离子的化合物,属于碱,故C正确;
D、硝酸是电离时生成的阳离子都是氢离子的化合物,属于酸,故D错误.
故选C.
点评 本题主要考查物质的分类的知识,解答时要分析物质的阴阳离子构成,然后再根据酸碱盐概念方面进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
17.A、B、C、D是四种短周期元素,它们的原子序数依次增大.其中A、D元素同主族,B、C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示:
常温下,甲物质为气体,密度略小于空气;乙物质为液体;丙物质和丁物质为固体且都为离子化合物.请填写下列空白:
(1)丙物质的化学式为NaH,丁物质中阴离子与阳离子的个数之比为1:2.
(2)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为H2O2?H++HO2-.
(3)某同学设计了一个以结构简式为 BA3-CA的物质为燃料的电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如图1:
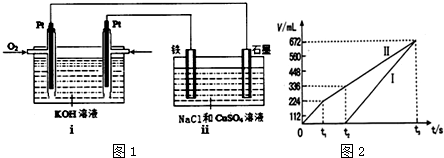
①写出ⅰ中通入该物质这一极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图2所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式2 H2O-4e-=O2↑+4 H+;;原混合液中CuSO4溶液物质的量浓度为0.1 mol/L.
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
(1)丙物质的化学式为NaH,丁物质中阴离子与阳离子的个数之比为1:2.
(2)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为H2O2?H++HO2-.
(3)某同学设计了一个以结构简式为 BA3-CA的物质为燃料的电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如图1:

①写出ⅰ中通入该物质这一极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图2所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式2 H2O-4e-=O2↑+4 H+;;原混合液中CuSO4溶液物质的量浓度为0.1 mol/L.
18.下列关系不正确的是( )
| A. | 非金属性:N>P>As>Sb>Bi | B. | 酸性:HNO3>H3PO4>H3AsO4>H3SbO4 | ||
| C. | 稳定性:NH3<PH3<AsH3<SbH3 | D. | 稳定性:HCl>H2S>PH3>SiH4 |
15.下列实验操作正确且能达到相应实验目的是( )
| 实验目的 | 实验操作 | |
| A | 称取2.0gNaOH固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
| B | 制备Fe(OH)3胶体 | 向氯化铁饱和溶液中逐滴加入少量NaOH溶液,加热煮沸至液体变为红褐色 |
| C | 证明碳酸的酸性强于硅酸 | CO2通入Na2SiO3溶液中,析出硅酸胶体 |
| D | 萃取碘水中的碘 | 将碘水倒入分液漏斗,然后再注入酒精,振荡,静置分层后,下层液体从下口放出,上层液体从上口倒出 |
| A. | A | B. | B | C. | C | D. | D |
12.25℃时,向10.0mL 0.2mol•L-1CH3COOH溶液中逐滴滴入0.1mol•L-1的NaOH溶液,下列有关溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 过程中可能有:c(Na+)>c(OH-)=c(CH3COO-)>c(H+) | |
| B. | 整个过程中都有:c(OH-)-c(H+)=c(Na+)-c(CH3COO-) | |
| C. | 当滴入10.0 mLNaOH溶液时有:c(CH3COOH)-c(CH3COO-)═2[c(OH-)-c(H+)] | |
| D. | 当滴入10.0 mLNaOH溶液时混合溶液的pH=4.75,则:c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-) |
19.下列离子方程式书写正确的是( )
| A. | 氯化铝与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 稀硫酸与氢氧化钡溶液反应:H++OH-+Ba2++SO42-═H2O+BaSO4↓ | |
| C. | 碳酸钙与稀盐酸反应:CO32--+2H+═H2O+CO2↑ | |
| D. | 向苏打溶液中加入足量的醋酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
17.以下物质间的每步转化通过一步反应就能实现的是( )
| A. | Al-Al2O3-Al(OH)3-NaAlO2 | B. | S-SO3-H2SO4-MgSO4 | ||
| C. | Mg-MgCl2-Mg(OH)2-MgO | D. | Si-SiO2-H2SiO3-Na2 SiO3 |