题目内容
15.下列实验操作正确且能达到相应实验目的是( )| 实验目的 | 实验操作 | |
| A | 称取2.0gNaOH固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
| B | 制备Fe(OH)3胶体 | 向氯化铁饱和溶液中逐滴加入少量NaOH溶液,加热煮沸至液体变为红褐色 |
| C | 证明碳酸的酸性强于硅酸 | CO2通入Na2SiO3溶液中,析出硅酸胶体 |
| D | 萃取碘水中的碘 | 将碘水倒入分液漏斗,然后再注入酒精,振荡,静置分层后,下层液体从下口放出,上层液体从上口倒出 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.NaOH易潮解,具有腐蚀性,应在小烧杯中称量;
B.向沸水中逐滴加入少量氯化铁饱和溶液,水解可制备胶体;
C.强酸能制取弱酸;
D.酒精与水互溶,不能作萃取剂.
解答 解:A.NaOH易潮解,具有腐蚀性,应在小烧杯中称量,且放在左盘,天平游码回零,砝码为2.0g,故A错误;
B.氯化铁与氢氧化钠反应生成氢氧化铁沉淀,得不到胶体,故B错误;
C.二氧化碳与水反应生成碳酸,向Na2SiO3溶液中通入CO2产生沉淀,可说明碳酸的酸性比硅酸强,故C正确;
D.酒精与水互溶,不能作萃取剂,应选苯或四氯化碳萃取碘水中的碘,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及实验操作、胶体制备、酸性比较及混合物分离提纯等,把握物质的性质、实验操作及实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
6.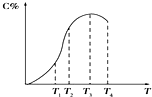 有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )
有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )
 有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )
有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )| A. | 温度为T2时该反应达到平衡 | |
| B. | 该反应为吸热反应 | |
| C. | 温度为T4时,v正<v逆 | |
| D. | 温度为 T3 T4时,该反应都处于平衡状态 |
3.下列说法中不正确的是(NA代表阿伏加德罗常数的值)( )
| A. | 13C与14C属于同一种元素,它们互为同位素 | |
| B. | 28g乙烯和氮气的混合气体中含有NA个气体分子 | |
| C. | 海轮外壳上镶入锌块,可减缓船体的腐蚀 | |
| D. | 常温下,1mol•L-1的 Na2CO3溶液中阴离子总数大于2NA |
7.下列物质中属于碱的是( )
| A. | KNO3 | B. | O3 | C. | Ca(OH)2 | D. | HNO3 |
4.醋酸溶液中存在电离平衡:CH3COOH═CH3COO-+H+,下列叙述不正确的是( )
| A. | CH3COOH溶液中离子浓度的关系满足:c(H+)>c(CH3COO-) | |
| B. | CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动 | |
| C. | 0.1mol/L的CH3COOH溶液加水稀释,溶液中的离子浓度均减小 | |
| D. | 常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH=7 |
5.现有原子序数依次增大的A、B、C、D、E、F六种短周期元素,它们可两两组成甲、乙、丙、丁、戊五种化合物,各化合物中原子个数比关系如下:
其中A、B两种元素的原子核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;B、C和D为同周期相邻元素,E和F位于同一周期,且二者原子序数之和为29.
(1)写出甲、丙、丁、戊四种物质的化学式:
甲H2O,丙Mg3N2,丁MgCl2,戊CCl4.
(2)乙的结构式为O=C=O,戊的一种用途是萃取剂、灭火剂或有机溶剂.
(3)化合物丙属于离子化合物(填“离子”或“共价”),丙具有类似盐类水解的性质,它与水反应可生成一种碱和一种常见气体,请写出丙与水反应的化学方程式:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑.
| 甲 | 乙 | 丙 | 丁 | 戊 |
| A:D=2:1 | B:D=1:2 | E:C=3:2 | E:F=1:2 | B:F=1:4 |
(1)写出甲、丙、丁、戊四种物质的化学式:
甲H2O,丙Mg3N2,丁MgCl2,戊CCl4.
(2)乙的结构式为O=C=O,戊的一种用途是萃取剂、灭火剂或有机溶剂.
(3)化合物丙属于离子化合物(填“离子”或“共价”),丙具有类似盐类水解的性质,它与水反应可生成一种碱和一种常见气体,请写出丙与水反应的化学方程式:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑.
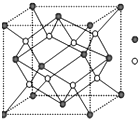 A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)