题目内容
17.A、B、C、D是四种短周期元素,它们的原子序数依次增大.其中A、D元素同主族,B、C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示:| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
(1)丙物质的化学式为NaH,丁物质中阴离子与阳离子的个数之比为1:2.
(2)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为H2O2?H++HO2-.
(3)某同学设计了一个以结构简式为 BA3-CA的物质为燃料的电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如图1:
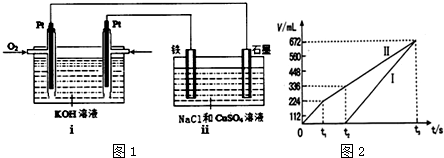
①写出ⅰ中通入该物质这一极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图2所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式2 H2O-4e-=O2↑+4 H+;;原混合液中CuSO4溶液物质的量浓度为0.1 mol/L.
分析 A、B、C、D是四种短周期元素,它们的原子序数依次增大.A、D元素同主族,二者形成原子个数1:1型离子化合物,含有金属元素,非金属元素,为ⅠA族元素,D的原子序数至少比A大3,可推知A为H、B为Na,丙为NaH;结合原子序数可知,B、C处于第二周期,A、B形成原子个数1:1的化合物甲为气体,密度略小于空气,甲应为C2H2,则B为碳元素;A、C形成原子个数1:1的化合物乙为液态,乙应为H2O2,则C为O元素;C、D形成原子个数1:1的离子化合物丁为Na2O2,据此解答.
解答 解:A、B、C、D是四种短周期元素,它们的原子序数依次增大.A、D元素同主族,二者形成原子个数1:1型离子化合物,含有金属元素,非金属元素,为ⅠA族元素,D的原子序数至少比A大3,可推知A为H、B为Na,丙为NaH;结合原子序数可知,B、C处于第二周期,A、B形成原子个数1:1的化合物甲为气体,密度略小于空气,甲应为C2H2,则B为碳元素;A、C形成原子个数1:1的化合物乙为液态,乙应为H2O2,则C为O元素;C、D形成原子个数1:1的离子化合物丁为Na2O2.
(1)由上述分析可知,丙为NaH,丁为Na2O2,由过氧根离子与钠离子构成,阴离子与阳离子的个数比为1:2;
故答案为:NaH;1:2;
(2)研究表明H2O2物质具有弱酸性,则H2O2物质在水中的电离方程式为:H2O2?H++HO2-,
故答案为:H2O2?H++HO2-;
(3)某同学设计以CH3OH物质为燃料的电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,
①ⅰ中通入甲醇一极为负极,碱性条件下生成碳酸根与水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
②Fe为阴极,石墨为阳极,开始阳极生成的气体为氯气,阴极为铜离子放电生成Cu,氯离子放电完毕,水放电生成氧气,当溶液中铜离子放电完毕,实质为电解水,阴极是氢离子放电生成氢气,在0~t1阶段为电解氯化铜溶液,在t1~t2阶段为电解硫酸铜溶液,
故在t1后,石墨电极上的电极反应式为2 H2O-4e-=O2↑+4 H+;
0~t1阶段电解生成氯气为$\frac{0.224L}{22.4L/mol}$=0.01mol,在t2时溶液中铜离子恰好放电完毕,t1~t2阶段生成氧气为336mL-224mL=112mL,其物质的量为$\frac{0.112L}{22.4L/mol}$=0.005mol,根据电子转移守恒,n(Cu2+)=$\frac{0.01mol×2+0.005mol×4}{2}$=0.02mol,故原混合液中CuSO4溶液物质的量浓度为$\frac{0.02mol}{0.2L}$=0.1mol/L
故答案为:2 H2O-4e-=O2↑+4 H+;0.1.
点评 本题比较综合,涉及元素化合物推断、原电池与电解原理、化学计算等,推断元素及物质是解题关键,需要学生熟练掌握基础知识,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | Na2CO3 固体中混有少量NaHCO3:加热固体至质量恒定 | |
| B. | NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体 | |
| C. | CO2中混有HCl:将其通过装NaOH溶液的洗气瓶 | |
| D. | NaCl溶液中混有少量I2:加入适量CCl4,振荡,静置,分液 |
| A. | Na2CO3溶液的碱性增强 | |
| B. | 阳极反应:CO32--2e-+H2O═CO2↑+2OH- | |
| C. | 溶液中CO32-+H2O?HCO3-+OH-平衡不移动 | |
| D. | 向溶液中加入一定量HCOOH的能复原 |
 如图
如图  为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽,接通电路后发现
为电镀槽,接通电路后发现 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是 ( )
后,使c、d两点短路.下列叙述正确的是 ( )| A. | a为直流电源的负极 | B. | c极发生的反应为2H++2e═-H2↑ | ||
| C. | f电极为锌板 | D. | e极发生还原反应 |
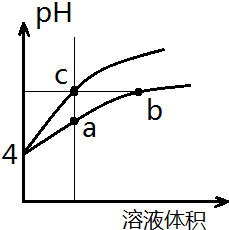 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A. | a、c两点溶液的导电能力相同 | |
| B. | b点溶液中c(H+)=c(OH-)+c(NH3•H2O) | |
| C. | a、b、c三点溶液水的电离程度a>b>c | |
| D. | 用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc |
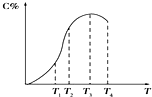 有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )
有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )| A. | 温度为T2时该反应达到平衡 | |
| B. | 该反应为吸热反应 | |
| C. | 温度为T4时,v正<v逆 | |
| D. | 温度为 T3 T4时,该反应都处于平衡状态 |
| A. | KNO3 | B. | O3 | C. | Ca(OH)2 | D. | HNO3 |
 A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)