题目内容
17.以下物质间的每步转化通过一步反应就能实现的是( )| A. | Al-Al2O3-Al(OH)3-NaAlO2 | B. | S-SO3-H2SO4-MgSO4 | ||
| C. | Mg-MgCl2-Mg(OH)2-MgO | D. | Si-SiO2-H2SiO3-Na2 SiO3 |
分析 A.Al2O3-Al(OH)3不能一步转化;
B.S-SO3不能一步转化;
C.Mg与盐酸反应生成氯化镁,氯化镁与碱反应生成氢氧化镁,氢氧化镁加热分解生成MgO;
D.SiO2-H2SiO3不能一步转化.
解答 解:A.氧化铝与水不反应,则Al2O3-Al(OH)3不能一步转化,故A不选;
B.S燃烧生成二氧化硫,则S-SO3不能一步转化,故B不选;
C.Mg$\stackrel{HCl}{→}$MgCl2$\stackrel{NaOH}{→}$Mg(OH)2$\stackrel{△}{→}$MgO,均可通过一步反应就能实现,故C选;
D.二氧化硅与水不反应,则SiO2-H2SiO3不能一步转化,故D不选;
故选C.
点评 本题考查金属及其化合物的性质等,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列物质中属于碱的是( )
| A. | KNO3 | B. | O3 | C. | Ca(OH)2 | D. | HNO3 |
5.现有原子序数依次增大的A、B、C、D、E、F六种短周期元素,它们可两两组成甲、乙、丙、丁、戊五种化合物,各化合物中原子个数比关系如下:
其中A、B两种元素的原子核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;B、C和D为同周期相邻元素,E和F位于同一周期,且二者原子序数之和为29.
(1)写出甲、丙、丁、戊四种物质的化学式:
甲H2O,丙Mg3N2,丁MgCl2,戊CCl4.
(2)乙的结构式为O=C=O,戊的一种用途是萃取剂、灭火剂或有机溶剂.
(3)化合物丙属于离子化合物(填“离子”或“共价”),丙具有类似盐类水解的性质,它与水反应可生成一种碱和一种常见气体,请写出丙与水反应的化学方程式:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑.
| 甲 | 乙 | 丙 | 丁 | 戊 |
| A:D=2:1 | B:D=1:2 | E:C=3:2 | E:F=1:2 | B:F=1:4 |
(1)写出甲、丙、丁、戊四种物质的化学式:
甲H2O,丙Mg3N2,丁MgCl2,戊CCl4.
(2)乙的结构式为O=C=O,戊的一种用途是萃取剂、灭火剂或有机溶剂.
(3)化合物丙属于离子化合物(填“离子”或“共价”),丙具有类似盐类水解的性质,它与水反应可生成一种碱和一种常见气体,请写出丙与水反应的化学方程式:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑.
12.已知碳酸钙的分解
①CaCO3(s)═CaO(s)+CO2(g)仅在高温下自发:氯酸钾的分解
②2KClO3(s)═2KCl(s)+3O2(g)在任何温度下都自发,下面有几组焓变数据,其中可能正确的是( )
①CaCO3(s)═CaO(s)+CO2(g)仅在高温下自发:氯酸钾的分解
②2KClO3(s)═2KCl(s)+3O2(g)在任何温度下都自发,下面有几组焓变数据,其中可能正确的是( )
| A. | △H1=-178.32kJ•mol-1△H2=+78.3kJ•mol-1 | |
| B. | △H1=+178.32kJ•mol-1△H2=-78.3kJ•mol-1 | |
| C. | △H1=-178.32kJ•mol-1△H2=+78.3kJ•mol-1 | |
| D. | △H1=+178.32kJ•mol-1△H2=+78.3kJ•mol-1 |
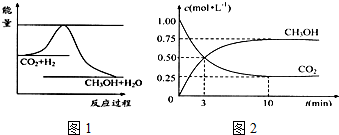
9.一氧化碳、氢气都是重要的化工原料,又可作为燃料.生产水煤气(主要成分为CO和H2)过程中发生的主要反应如下:①C(g)+CO2(g)?2CO(g)△H1
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2
③C(s)+H2O(g)?CO(g)+H2(g)△H3
回答下列问题:
则△H2=(a+2b-c-2d)kJ•mol-1kJ.mol-1(用含a,b,c,d字母的代数式表示).
(2)反应③的化学平衡常数K的表达式为K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$;上述反应中△H1、△H2、△H3之间的关系为△H3=△H1+△H2.
(3)不同温度下反应②的平衡常数如下表所示,则△H2<0(填“<”或“>”)
500℃时,若起始时密闭容器中充有物质的量浓度均为0.02mol•L-1的CO和H2O.则反应②达到化学平衡时CO的转化率为75%.
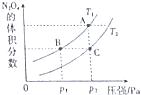
(4)对于反应2NO2(g)?N2O4(g)△H<0,当温度为T1、T2时,平衡体系中的体积分数随压强变化的曲线如图所示,则T1<T2(填“<”或“>”);压强增大,平衡向正(填“正”或“逆”)反应方向移动,B、C两点的平衡常数B>C(填“>”、“<”或“=”)
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2
③C(s)+H2O(g)?CO(g)+H2(g)△H3
回答下列问题:
| 化学键 | C≡O | H-O | H-H | C═O |
| E/(kJ.mol-1) | a | b | c | d |
(2)反应③的化学平衡常数K的表达式为K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$;上述反应中△H1、△H2、△H3之间的关系为△H3=△H1+△H2.
(3)不同温度下反应②的平衡常数如下表所示,则△H2<0(填“<”或“>”)
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(4)对于反应2NO2(g)?N2O4(g)△H<0,当温度为T1、T2时,平衡体系中的体积分数随压强变化的曲线如图所示,则T1<T2(填“<”或“>”);压强增大,平衡向正(填“正”或“逆”)反应方向移动,B、C两点的平衡常数B>C(填“>”、“<”或“=”)

6.如图所示的四种短周期元素W、X、Y、Z,它们的原子最外层电子数之和为22,下列说法正确的是( )
| X | Y | ||
| W | Z |
| A. | X、Y、Z三种元素气态氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | W、X、Z三种元素最高价氧化物对应的水化物的酸性依次增强 | |
| D. | W、X、Z三种元素最高正化合价依次升高 |
9.已知常温下,在溶液中发生如下反应,由此推断下列说法正确的是( )
①16H++10Z-+2XO4-═2X2++5Z2+8H2O;
②2A2++B2═2A3-+2B-;
③2B-+Z2═B2+2Z-.
①16H++10Z-+2XO4-═2X2++5Z2+8H2O;
②2A2++B2═2A3-+2B-;
③2B-+Z2═B2+2Z-.
| A. | Z元素在反应①中被还原,在反应③中被氧化 | |
| B. | 反应Z2+2A2+═2A3++2Z-可以进行 | |
| C. | 氧化性由强到弱的顺序是XO4-,Z2,B2,A3+ | |
| D. | 还原性由强到弱的顺序是Z-,B-,A2+,X2+ |