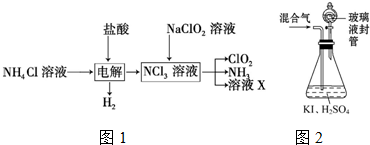
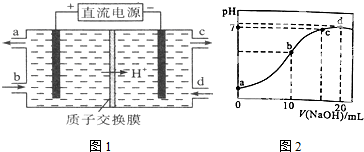
题目内容
2.氢氰酸HCN电离常数为4×10-10,将含有5.01gHCl的水溶液和6.74gNaCN混合,并加水稀释到0.275dm3,求H3O+,CN-,HCN的浓度是多少?(MHCl=36.46g•mol-1,MNaCN=49.01g•mol-1)分析 根据n=$\frac{m}{M}$分别计算出HCl、NaCN的物质的量,然后计算出生成HCN的物质的量,再根据c=$\frac{n}{V}$计算出HCN浓度,设混合液中H3O+的浓度为x,则c(H3O+)≈c(CN-)=x,HCN的浓度为0.5-x,结合电离平衡常数的表达式列式计算.
解答 解:5.01g HCl的物质的量为:$\frac{5.01g}{36.46g/mol}$=0.1375mol,6.74gNaCN的物质的量为:$\frac{6.74g}{49.01g}$=0.1375mol,
两溶液恰好反应生成0.1375molHCN,反应后HCN的浓度为:$\frac{0.1375mol}{0.275L}$=0.5mol/L,
设混合液中H3O+的浓度为x,则c(H3O+)≈c(CN-)=x,HCN的浓度为0.5-x,
根据HCN的平衡常数可知:K=$\frac{x×x}{0.5-x}$=4×10-10,解得:x≈1.414×10-5mol/L,
则H3O+,CN-的浓度分别为1.414×10-5mol/L、1.414×10-5mol/L,HCN的浓度约为0.500mol/L,
答:H3O+,CN-、HCN的浓度分别为1.414×10-5mol/L;1.414×10-5mol/L;0.500mol/L.
点评 本题考查了电离平衡常数的计算,题目难度中等,明确电离平衡常数的概念及表达式为解答关键,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
12.保持温度不变,用惰性电极电解足量饱和的Na2CO3溶液,一段时间后下列叙述正确的是( )
| A. | Na2CO3溶液的碱性增强 | |
| B. | 阳极反应:CO32--2e-+H2O═CO2↑+2OH- | |
| C. | 溶液中CO32-+H2O?HCO3-+OH-平衡不移动 | |
| D. | 向溶液中加入一定量HCOOH的能复原 |
13.铜和镁的合金4.7克完全溶于浓硝酸中,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已经折算成标准状况).在反应后的溶液中加入足量的NaOH溶液,生成沉淀的质量为( )
| A. | 9.02g | B. | 8.26g | C. | 8.61g | D. | 7.04g |
17.在含有Fe3+、Fe2+、Al3+、Cl-的稀溶液中,加入足量的Na2O2固体并微热,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目没有明显变化的是( )
| A. | Fe3+ | B. | Fe2+ | C. | Al3+ | D. | Cl- |
7.下列物质中属于碱的是( )
| A. | KNO3 | B. | O3 | C. | Ca(OH)2 | D. | HNO3 |
11.下列说法正确的是( )
| A. | BaSO4难溶于水,但BaSO4是电解质 | |
| B. | 铜和石墨均能导电,所以它们都是电解质 | |
| C. | 电解质一定能导电,能导电的物质不一定属于电解质 | |
| D. | 液态HCl不导电,所以HCl不是电解质 |
12.已知碳酸钙的分解
①CaCO3(s)═CaO(s)+CO2(g)仅在高温下自发:氯酸钾的分解
②2KClO3(s)═2KCl(s)+3O2(g)在任何温度下都自发,下面有几组焓变数据,其中可能正确的是( )
①CaCO3(s)═CaO(s)+CO2(g)仅在高温下自发:氯酸钾的分解
②2KClO3(s)═2KCl(s)+3O2(g)在任何温度下都自发,下面有几组焓变数据,其中可能正确的是( )
| A. | △H1=-178.32kJ•mol-1△H2=+78.3kJ•mol-1 | |
| B. | △H1=+178.32kJ•mol-1△H2=-78.3kJ•mol-1 | |
| C. | △H1=-178.32kJ•mol-1△H2=+78.3kJ•mol-1 | |
| D. | △H1=+178.32kJ•mol-1△H2=+78.3kJ•mol-1 |