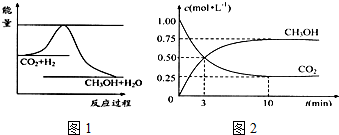
题目内容
16.根据反应8NH3+3Cl2═6NH4Cl+N2回答下列问题:(1)该反应中氧化剂是Cl2,该物质具有氧化性;被氧化的元素是N,氧化产物是N2.
(2)该反应中被氧化的物质与被还原的物质的物质的量之比为2:3.
(3)反应中每生成22.4L(标准状况下)N2,转移电子6mol.
分析 (1)所含元素化合价降低的反应物为氧化剂,氧化剂具有氧化性;元素化合价升高发生氧化反应,得到氧化产物;
(2)反应中氨气被氧化、氯气被还原,根据电子转移守恒计算被氧化的物质与被还原的物质的物质的量之比;
(3)根据n=$\frac{V}{{V}_{m}}$计算氮气物质的量,再根据N元素化合价变化计算转移电子.
解答 解:(1)反应中氯气中氯元素化合价由0价降低为氯化铵中-1价,故Cl2是氧化剂,具有氧化性,N元素化合价升高为氮气中0价,故N元素发生氧化反应,为氧化产物,
故答案为:Cl2;氧化;N;N2;
(2)反应中氨气被氧化、氯气被还原,根据电子转移守恒,被氧化的物质与被还原的物质的物质的量之比为2×[0-(-1)]:[0-(-3)]=2:3,
故答案为:2:3;
(3)氮气物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,故转移电子为1mol×2×[0-(-3)]=6mol,
故答案为:6.
点评 本题考查氧化还原反应基本概念与计算,难度不大,注意根据化合价把握氧化还原反应基本概念.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.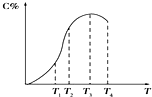 有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )
有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )
 有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )
有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )| A. | 温度为T2时该反应达到平衡 | |
| B. | 该反应为吸热反应 | |
| C. | 温度为T4时,v正<v逆 | |
| D. | 温度为 T3 T4时,该反应都处于平衡状态 |
7.下列物质中属于碱的是( )
| A. | KNO3 | B. | O3 | C. | Ca(OH)2 | D. | HNO3 |
4.醋酸溶液中存在电离平衡:CH3COOH═CH3COO-+H+,下列叙述不正确的是( )
| A. | CH3COOH溶液中离子浓度的关系满足:c(H+)>c(CH3COO-) | |
| B. | CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动 | |
| C. | 0.1mol/L的CH3COOH溶液加水稀释,溶液中的离子浓度均减小 | |
| D. | 常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH=7 |
11.下列说法正确的是( )
| A. | BaSO4难溶于水,但BaSO4是电解质 | |
| B. | 铜和石墨均能导电,所以它们都是电解质 | |
| C. | 电解质一定能导电,能导电的物质不一定属于电解质 | |
| D. | 液态HCl不导电,所以HCl不是电解质 |
1.银锌电池广泛用做各种电子仪器的电源,它的电池反应是:Zn+Ag2O+H2O═2Ag+Zn(OH)2,则正极上发生反应的物质是( )
| A. | Ag | B. | Zn(OH)2 | C. | Ag2O | D. | Zn |
5.现有原子序数依次增大的A、B、C、D、E、F六种短周期元素,它们可两两组成甲、乙、丙、丁、戊五种化合物,各化合物中原子个数比关系如下:
其中A、B两种元素的原子核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;B、C和D为同周期相邻元素,E和F位于同一周期,且二者原子序数之和为29.
(1)写出甲、丙、丁、戊四种物质的化学式:
甲H2O,丙Mg3N2,丁MgCl2,戊CCl4.
(2)乙的结构式为O=C=O,戊的一种用途是萃取剂、灭火剂或有机溶剂.
(3)化合物丙属于离子化合物(填“离子”或“共价”),丙具有类似盐类水解的性质,它与水反应可生成一种碱和一种常见气体,请写出丙与水反应的化学方程式:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑.
| 甲 | 乙 | 丙 | 丁 | 戊 |
| A:D=2:1 | B:D=1:2 | E:C=3:2 | E:F=1:2 | B:F=1:4 |
(1)写出甲、丙、丁、戊四种物质的化学式:
甲H2O,丙Mg3N2,丁MgCl2,戊CCl4.
(2)乙的结构式为O=C=O,戊的一种用途是萃取剂、灭火剂或有机溶剂.
(3)化合物丙属于离子化合物(填“离子”或“共价”),丙具有类似盐类水解的性质,它与水反应可生成一种碱和一种常见气体,请写出丙与水反应的化学方程式:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑.
6.如图所示的四种短周期元素W、X、Y、Z,它们的原子最外层电子数之和为22,下列说法正确的是( )
| X | Y | ||
| W | Z |
| A. | X、Y、Z三种元素气态氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | W、X、Z三种元素最高价氧化物对应的水化物的酸性依次增强 | |
| D. | W、X、Z三种元素最高正化合价依次升高 |