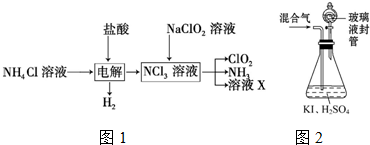
题目内容
18.下列关系不正确的是( )| A. | 非金属性:N>P>As>Sb>Bi | B. | 酸性:HNO3>H3PO4>H3AsO4>H3SbO4 | ||
| C. | 稳定性:NH3<PH3<AsH3<SbH3 | D. | 稳定性:HCl>H2S>PH3>SiH4 |
分析 A.同一主族元素,元素非金属性随着原子序数增大而减弱;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:A.同一主族元素,元素非金属性随着原子序数增大而减弱,所以非金属性N>P>As>Sb>Bi,故A正确;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性N>P>As>Sb,所以酸性:HNO3>H3PO4>H3AsO4>H3SbO4,故B正确;
C.元素的非金属性越强,其氢化物的稳定性越强,非金属性N>P>As>Sb,所以稳定性:NH3>PH3>AsH3>SbH3,故C错误;
D.元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>S>P>Si,所以稳定性:HCl>H2S>PH3>SiH4,故D正确;
故选C.
点评 本题考查元素周期律,为高频考点,明确同一周期、同一主族元素原子结构、元素性质递变规律是解本题关键,注意:氢化物的稳定性与化学键有关,但氢化物的熔沸点与相对分子质量有关,题目难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
8.下列除杂质的操作中不正确的是( )
| A. | Na2CO3 固体中混有少量NaHCO3:加热固体至质量恒定 | |
| B. | NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体 | |
| C. | CO2中混有HCl:将其通过装NaOH溶液的洗气瓶 | |
| D. | NaCl溶液中混有少量I2:加入适量CCl4,振荡,静置,分液 |
9.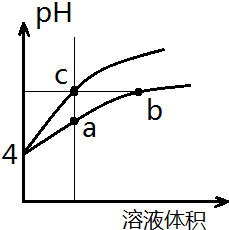 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A. | a、c两点溶液的导电能力相同 | |
| B. | b点溶液中c(H+)=c(OH-)+c(NH3•H2O) | |
| C. | a、b、c三点溶液水的电离程度a>b>c | |
| D. | 用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc |
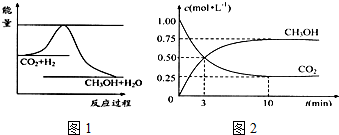
6. 有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )
有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )
 有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )
有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )| A. | 温度为T2时该反应达到平衡 | |
| B. | 该反应为吸热反应 | |
| C. | 温度为T4时,v正<v逆 | |
| D. | 温度为 T3 T4时,该反应都处于平衡状态 |
13.铜和镁的合金4.7克完全溶于浓硝酸中,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已经折算成标准状况).在反应后的溶液中加入足量的NaOH溶液,生成沉淀的质量为( )
| A. | 9.02g | B. | 8.26g | C. | 8.61g | D. | 7.04g |
3.下列说法中不正确的是(NA代表阿伏加德罗常数的值)( )
| A. | 13C与14C属于同一种元素,它们互为同位素 | |
| B. | 28g乙烯和氮气的混合气体中含有NA个气体分子 | |
| C. | 海轮外壳上镶入锌块,可减缓船体的腐蚀 | |
| D. | 常温下,1mol•L-1的 Na2CO3溶液中阴离子总数大于2NA |
7.下列物质中属于碱的是( )
| A. | KNO3 | B. | O3 | C. | Ca(OH)2 | D. | HNO3 |