题目内容
19.室温下,关于下列溶液的说法正确的是( )
| A. | 25℃时①10-3mol/L的盐酸;②pH=3的NH4Cl溶液;③pH=11的氨水中,水的电离程度为:②>③>① | |
| B. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| C. | pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+) | |
| D. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+c(CH3COOH) |
分析 A.酸碱抑制水的电离,盐促进水的电离;
B.根据电荷守恒和物料守恒分析;
C.pH=8.0的KHS溶液中,HS-的水解程度大于电离程度;
D.a点溶液中溶质为等物质的量的NaOH和醋酸钠,根据电荷守恒和物料守恒分析.
解答 解:A.①10-3mol/L的盐酸;③pH=11的氨水中两种溶液中氢离子浓度和氢氧根离子浓度相同,对水的抑制程度相同,氯化铵促进水的电离,所以水的电离程度为:②>③=①,故A错误;
B.pH=1的NaHSO4溶液,物料守恒为c(Na+)=c(SO42-),电荷守恒为c(H+)+c(Na+)=2c(SO42-)+c(OH-),所以c(H+)=c(SO42-)+c(OH-),故B正确;
C.pH=8.0的KHS溶液中,HS-的水解程度大于电离程度,HS-和水均能电离出氢离子,所以c(H+)>c(S2-),则c(K+)>c(HS-)>c(OH-)>c(H+)>c(S2-),故C错误;
D.a点溶液中溶质为等物质的量的NaOH和醋酸钠,电荷守恒为c(H+)+c(Na+)=c(OH-)=c(CH3COO-),物料守恒为:c(Na+)=2c(CH3COO-)+2c(CH3COOH),
则c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH),故D错误.
故选B.
点评 本题考查了弱电解质电离平衡、盐类水解应用、溶液酸碱性的计算判断等,注意把握溶液中物料守恒和电荷守恒的应用,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
10.化学与生产、生活密切相关,下列对有关现象及事实的解释正确的是( )
| 现象或事实 | 主要原因 | |
| A | 燃煤中添加适量CaO可减少SO2排放量 | 燃烧中硫元素转化为CaSO3 |
| B | 聚氯乙烯薄膜不能用于包装食品 | 会造成白色污染 |
| C | 夏天雷雨过后感觉到空气特别的清新 | 空气中O3含量增加、尘埃减少 |
| D | 蒸熟的糯米在适当条件可转化为香甜可口的甜酒 | 部分淀粉水解生成葡萄糖与乙醇 |
| A. | A | B. | B | C. | C | D. | D |
7.下列配制的溶液浓度偏高的是( )
| A. | 配制盐酸溶液用量筒量取盐酸时,俯视刻度线 | |
| B. | NaOH溶解后未经冷却就注入容量瓶并定容至刻度线 | |
| C. | 称量11.7 g NaCl配制0.2 mol•L-1NaCl溶液1 000 mL时,砝码错放在左盘 | |
| D. | 配制盐酸溶液定容时,仰视容量瓶刻度线 |
14.EPA、DHA均为不饱和羧酸.1mol分子式为C67H96O6的某种鱼油完全水解后生成1mol 甘油(C3H8O3),1mol EPA和2mol DHA,EPA,DHA的分子式分别为( )
| A. | C20H30O2、C22H30O2 | B. | C22H32O2、C20H30O2 | ||
| C. | C22H30O2、C20H30O2 | D. | C20H30O2、C22H32O2 |
4.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 20 g D2O所含的电子数为10 NA | |
| B. | 6.0gSiO2晶体中含有0.2NA个Si-O键 | |
| C. | 氢气与氯气反应生成标准状况下22.4 L氯化氢,断裂化学键总数为2 NA | |
| D. | 苯与液溴反应生成1mol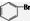 时消耗0.5NA个Br2 时消耗0.5NA个Br2 |
11.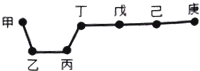 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )| A. | 甲与己形成的化合物一定是离子化合物 | |
| B. | 简单气态氢化物的稳定性:庚>己>戊 | |
| C. | 乙、丙、丁的最高价氧化物水化物可以相互反应 | |
| D. | 庚的最高价氧化物水化物酸性最强 |
8.用如图装置实验,下列实验现象预期及相应结论均正确的是( )
| 选项 | a | b | 实验现象预期 | 结论 | 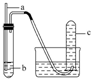 |
| A | 铜丝 | 稀硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 | |
| B | 木条 | 18.4mol•L-1 硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 | |
| C | 生铁 | 醋酸溶液 | c中有大量无色气体 | 生铁发生析氢腐蚀 | |
| D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |
| A. | A | B. | B | C. | C | D. | D |
 .
.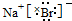 .
.