题目内容
8.用如图装置实验,下列实验现象预期及相应结论均正确的是( )| 选项 | a | b | 实验现象预期 | 结论 | 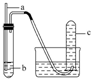 |
| A | 铜丝 | 稀硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 | |
| B | 木条 | 18.4mol•L-1 硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 | |
| C | 生铁 | 醋酸溶液 | c中有大量无色气体 | 生铁发生析氢腐蚀 | |
| D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Cu和稀硝酸反应生成NO,NO不稳定,易被氧气氧化生成二氧化氮,二氧化氮和水反应生成硝酸和NO;
B.浓硫酸将木材中的H、O元素以2:1水的形式脱去而体现脱水性;
C.强酸性条件下,生铁发生析氢腐蚀;
D.Fe和稀盐酸反应生成无色气体氢气,氯化亚铁和双氧水发生氧化反应生成氯化铁.
解答 解:A.稀硝酸与铜反应生成的一氧化氮是无色气体,故A错误;
B.木条变黑说明浓硫酸有脱水性,但不能证明有酸性,故B错误;
C.醋酸溶液呈酸性,发生析氢腐蚀,故C正确;
D.铁与盐酸反应生成氯化亚铁,氯化亚铁与双氧水反应生成氯化铁,催化剂为氯化铁,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及物质性质、金属的腐蚀与防护等知识点,明确实验原理、物质性质是解本题关键,侧重考查学生分析判断能力,注意浓硫酸吸水性和脱水性区别,知道钢铁发生吸氧腐蚀和析氢腐蚀条件,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
18.氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.
(1)基态砷原子的核外电子排布式为[Ar]3d104s24p3.氮、磷、砷的第一电离能顺序为N>P>As(填元素符号).
(2)已知N2O为直线形结构,结构式为N=N=O.则N2O是极性(填“极性”或“非极性”)分子.中间的氮原子的杂化轨道类型为sp杂化.
(3)已知下列数据:
NH3的熔、沸点均高于PH3的原因是氨分子之间能形成氢键;PH3的分解温度高于其沸点,其原因是PH3分解需要破坏P-H键,PH3气化需要破坏分子间作用力,而化学键比分子间作用力强得多.
(4)根据价层电子对互斥理论,氨分子中的键角<(填“>”、“<”或“=”)109°28′;PO43-离子的空间构型为正四面体.
(5)磷化铝的结构与金刚石相似,其结构单元如图所示:
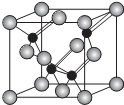
①经过计算,该晶体的化学式是AlP.
②该晶体中是(填“是”或“否”)存在配位键.
(1)基态砷原子的核外电子排布式为[Ar]3d104s24p3.氮、磷、砷的第一电离能顺序为N>P>As(填元素符号).
(2)已知N2O为直线形结构,结构式为N=N=O.则N2O是极性(填“极性”或“非极性”)分子.中间的氮原子的杂化轨道类型为sp杂化.
(3)已知下列数据:
| 物质 | 熔点/K | 沸点/K | 分解温度/K |
| NH3 | 195.3 | 239.7 | 1073 |
| PH3 | 139.2 | 185.4 | 713.2 |
(4)根据价层电子对互斥理论,氨分子中的键角<(填“>”、“<”或“=”)109°28′;PO43-离子的空间构型为正四面体.
(5)磷化铝的结构与金刚石相似,其结构单元如图所示:

①经过计算,该晶体的化学式是AlP.
②该晶体中是(填“是”或“否”)存在配位键.
19.室温下,关于下列溶液的说法正确的是( )


| A. | 25℃时①10-3mol/L的盐酸;②pH=3的NH4Cl溶液;③pH=11的氨水中,水的电离程度为:②>③>① | |
| B. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| C. | pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+) | |
| D. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+c(CH3COOH) |
16.化学与人类社会生产、生活密切相关,下列说法正确的是( )
| A. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 | |
| B. | 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2 | |
| C. | 陶瓷、砖瓦、玻璃、水泥等,都是硅酸盐产品 | |
| D. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
13.化学与人类生活密切相关,下列与化学有关的说法正确的是( )
| A. | 贮氢金属并不是简单地吸附氢气,而是通过化学反应贮存氢气 | |
| B. | 光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及生物质能的利用 | |
| C. | 煤的主要成分为单质碳、苯、二甲苯等,因而可通过煤的干馏将它们分离 | |
| D. | 化学药品着火,都要立即用水或泡沫灭火器灭火 |
20.用NA表示阿伏加德罗常数的值.下列叙述不正确的是( )
| A. | 25℃时,pH=13的氨水和NaOH溶液各1.0 L含有的OH-数目均为0.1NA | |
| B. | 常温常压下,由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| C. | 22 gD218O分子中,含有质子数和中子数分别为10NA和12NA | |
| D. | 标准状况下,22.4 L CCl4中含有的C-Cl键数目为4NA |
17.以甲醇为主要原料,电化学合成碳酸二甲酯工作原理如图所示.下列说法正确的是( )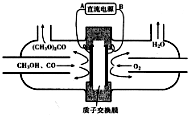

| A. | 外电源负极为A极 | |
| B. | 阳极的电极反应:2CH3OH+CO-2e-═(CH3O)2CO+2H+ | |
| C. | H+从右向左通过质子交换膜 | |
| D. | 电解槽中添加少量烧碱有利于导电 |
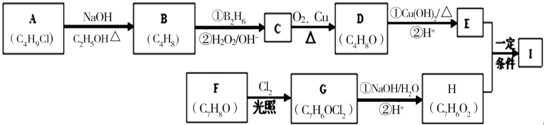
 .
. .
. .
.