题目内容
14.EPA、DHA均为不饱和羧酸.1mol分子式为C67H96O6的某种鱼油完全水解后生成1mol 甘油(C3H8O3),1mol EPA和2mol DHA,EPA,DHA的分子式分别为( )| A. | C20H30O2、C22H30O2 | B. | C22H32O2、C20H30O2 | ||
| C. | C22H30O2、C20H30O2 | D. | C20H30O2、C22H32O2 |
分析 1mol分子式为C67H96O6的某种鱼油完全水解后生成1mol 甘油(C3H8O3)即丙三醇,1mol EPA和2mol DHA,而EPA、DHA均为不饱和羧酸,故C67H96O6为三元酯,据此分析.
解答 解:1mol分子式为C67H96O6的某种鱼油完全水解后生成1mol 甘油(C3H8O3)即丙三醇,1mol EPA和2mol DHA,而EPA、DHA均为不饱和羧酸,故C67H96O6为三元酯,即故方程式可以表示为:C3H8O3+EPA+2DHA$→_{△}^{浓硫酸}$C67H96O6+3H2O,根据原子个数守恒可知,1molEPA和2mol DHA的分子式之和为C64H94O6,故选D.
点评 本题考查了有机物分子式的确定,应注意的是酸和醇在发生酯化反应时,除了生成酯还生成水,且生成的值为几元,则就生成几分子水,难度不大.

练习册系列答案
相关题目
4.自来水中游离氯的测定.设计如下实验:取一定量自来水置于锥形瓶中,加入足量的KI溶液及2~3滴指示剂,用0.0010mol•L-1的Na2S2O3溶液滴定反应中生成的I2(I2被还原为I-,S2O32-被氧化为S4O62-),根据消耗的Na2S2O3溶液的体积计算出自来水中游离氯的浓度.请回答下列问题:
(1)写出Na2S2O3与I2反应的离子方程式I2+2S2O32-=2I-+S4O62-.
(2)滴定中使用的指示剂是淀粉溶液,滴定终点的现象是蓝色溶液恰好变为无色且半分钟内不恢复.
(3)该小组同学的实验数据如下表:
请根据上表数据计算该自来水中游离氯(Cl2)的物质的量浓度.0.0010mol•L-1(写出计算过程,否则不得分)
(4)若实验中的锥形瓶用自来水洗净后未用蒸馏水洗涤,则实验值大于(填“大于、小于或等于”)实际值.
(1)写出Na2S2O3与I2反应的离子方程式I2+2S2O32-=2I-+S4O62-.
(2)滴定中使用的指示剂是淀粉溶液,滴定终点的现象是蓝色溶液恰好变为无色且半分钟内不恢复.
(3)该小组同学的实验数据如下表:
| 实验序号 | 自来水的体积 | KI溶液的体积 | 消耗的Na2S2O3溶液的体积 |
| 1 | 10.00mL | 10.00mL | 19.96mL |
| 2 | 10.00mL | 10.00mL | 20.04mL |
(4)若实验中的锥形瓶用自来水洗净后未用蒸馏水洗涤,则实验值大于(填“大于、小于或等于”)实际值.
5.甲烷的用途很广泛.
(1)已知:
2NO2(g )═N2O4(g)△H=-56.9kJ•mol -1
H2O(g)=H2O(l)△H=-44.0kJ•mol -1
CH4(g)+N2O4 (g)=N2(g)+2H2O(l)+CO2 (g)△H=-898.1kJ•mol -1
则 CH4(g)催化还原NO2 (g)生成 N2(g)和H2O(g)的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H=-867kJ•mol-1.
(2)一定条件下,发生2NO(g)+2CO(g)$\stackrel{催化剂}{?}$N2(g)+2CO2(g)△H<0.在不同时间c(NO)与c(CO)如下表所示:
①该温度下,该反应的平衡常数表达式为K=$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$;
②计算前4秒内氮气的平均反应速率为9.375×10-5mol/(L•s);
③下列选项中,不能说明上述反应已达平衡的是AC
A.2v正(NO)=v逆(N2 )
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中CO的质量不再发生变化
E. 容器中气体的总压强不随时间而变化
(3)CH4燃料电池原理如图所示
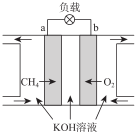
①该燃料电池的正极为b(填“a”或“b”).该电池负极的电极反应式为CH4+10OH--8e-=CO32-+7H2O;
②放电一段时间后,电解质溶液的pH减小(填“增大”、“减小”或“不变”).
(1)已知:
2NO2(g )═N2O4(g)△H=-56.9kJ•mol -1
H2O(g)=H2O(l)△H=-44.0kJ•mol -1
CH4(g)+N2O4 (g)=N2(g)+2H2O(l)+CO2 (g)△H=-898.1kJ•mol -1
则 CH4(g)催化还原NO2 (g)生成 N2(g)和H2O(g)的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H=-867kJ•mol-1.
(2)一定条件下,发生2NO(g)+2CO(g)$\stackrel{催化剂}{?}$N2(g)+2CO2(g)△H<0.在不同时间c(NO)与c(CO)如下表所示:
| 时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
②计算前4秒内氮气的平均反应速率为9.375×10-5mol/(L•s);
③下列选项中,不能说明上述反应已达平衡的是AC
A.2v正(NO)=v逆(N2 )
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中CO的质量不再发生变化
E. 容器中气体的总压强不随时间而变化
(3)CH4燃料电池原理如图所示

①该燃料电池的正极为b(填“a”或“b”).该电池负极的电极反应式为CH4+10OH--8e-=CO32-+7H2O;
②放电一段时间后,电解质溶液的pH减小(填“增大”、“减小”或“不变”).
19.室温下,关于下列溶液的说法正确的是( )


| A. | 25℃时①10-3mol/L的盐酸;②pH=3的NH4Cl溶液;③pH=11的氨水中,水的电离程度为:②>③>① | |
| B. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| C. | pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+) | |
| D. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+c(CH3COOH) |
6.某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将Fe3+转化为Fe2+(如图)
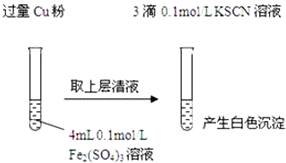
(1)Fe3+与Cu粉发生反应的离子方程式为2Fe3++Cu═2Fe2++Cu2+.
(2)探究白色沉淀产生的原因,请填写实验方案:查阅资料:
ⅰ.SCN-的化学性质与I-相似,ⅱ.2Cu2++4I-=2CuI↓(白色)+I2
Cu2+与SCN-反应的离子方程式为2Cu2++4SCN-=2Cu(SCN)↓+(SCN)2.
实验Ⅱ:将Fe2+转化为Fe3+
探究上述现象出现的原因:查阅资料:Fe2++NO?Fe(NO)2+(棕色)
(3)用离子方程式解释NO 产生的原因3Fe2++4H++NO3-═3Fe3++NO↑+2H2O.
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ慢(填“快”或“慢”).
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是取反应后的黄色溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液或者KMnO4,溶液无明显变化,说明反应I是不可逆反应.
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡Fe2++NO?Fe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色.
实验Ⅰ:将Fe3+转化为Fe2+(如图)

(1)Fe3+与Cu粉发生反应的离子方程式为2Fe3++Cu═2Fe2++Cu2+.
(2)探究白色沉淀产生的原因,请填写实验方案:查阅资料:
ⅰ.SCN-的化学性质与I-相似,ⅱ.2Cu2++4I-=2CuI↓(白色)+I2
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL0.1mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
| 步骤2:取取4mL0.1mol/LFeSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
实验Ⅱ:将Fe2+转化为Fe3+
| 实验方案 | 现象 |
| 向3mL 0.1mol/L FeSO4溶液中加入1mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
(3)用离子方程式解释NO 产生的原因3Fe2++4H++NO3-═3Fe3++NO↑+2H2O.
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ慢(填“快”或“慢”).
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是取反应后的黄色溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液或者KMnO4,溶液无明显变化,说明反应I是不可逆反应.
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡Fe2++NO?Fe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色.
4.下列实验所对应的离子方程式正确的是( )
| A. | 向漂白粉溶液中通入SO2:Ca2++ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| C. | 在碳酸氢钡溶液中加入过量的氢氧化钠溶液:Ba2++2HCO3-+2OH-═BaCO3↓+CO32-+2H2O | |
| D. | 向Na2S2O3溶液中加入稀硫酸:S2O32-+4H+═SO42-+3S↓+2H2O |
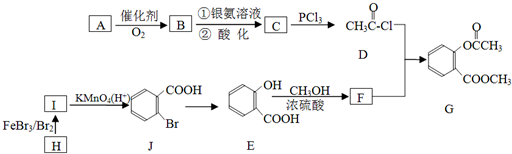
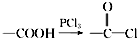 ,请回答以下问题:
,请回答以下问题: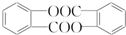 .
.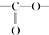 结构
结构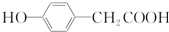 .
.