题目内容
9.有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水蒸气发生反应,生成的产物为NH3,该反应的热化学方程式如下:2N2(g)+6H2O(g)?4NH3(g)+3O2(g)△H=akJ/mol,回答下列问题:(1)在光照,恒容的密闭容器中,测得在不同温度下反应中NH3物质的量随时间变化如图1所示,则该反应的T1、T2、T3之间的大小关系为T1>T2>T3,合成反应的a>0(填“>”、“<”或“=”)
(2)在一固定体积的容器中进行如上实验,能说明该反应己经达到平衡的是ac
a.单位时间内生成1molN2同时生成2molNH3
b.混合气体的密度保持不变
c.体系中压强保持不变
d.各物质的浓度之比为2:6;4:3
(3)某温度下,往一密闭容器中通入一定量的N2和H2O,请在图2中画出在不同压强P1、P2(P1>P2)下的N2的物质的量随时间的变化关系图.
(4)目前工业常使用N2和H2来合成氨气,已知2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,请写出工业合成氨的热化学方程式:N2(g)+3H2(g)=NH3(g)△H=(a-1452)KJ/mol
(5)500℃下,在一容积为1.0L的密闭容器中,通入0.60molN2和1.8molH2,反应在一定条件下达到平衡时,NH3的物质的量分数为20%,计算此时N2的转化率(写出计算方程,计算结果保留两位有效数字.
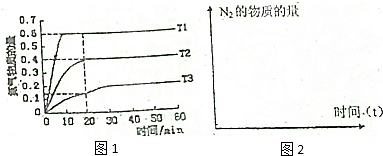
分析 (1)先拐先平温度高,T1>T2>T3,温度越高氨气物质的量越大;
(2)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,结合反应的特点进行分析;
(3)某温度下,往一密闭容器中通入一定量的N2和H2O,反应前后气体体积减小,压强越大氮气物质的量越小,但反应速率大,达到平衡所需时间短,据此画出变化图象;
(4)依据热化学方程式和盖斯定律计算,
①2N2(g)+6H2O(g)?4NH3(g)+3O2(g)△H=akJ/mol,
②2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,
(①+②×3)×$\frac{1}{2}$得到合成氨的热化学方程式.
解答 解:(1)图象分析可知,先拐先平温度高,T1>T2>T3,温度越高氨气物质的量越大说明反应是吸热反应,反应焓变大于0,
故答案为:T1>T2>T3;>;
(2)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,2N2(g)+6H2O(g)?4NH3(g)+3O2(g)△H=akJ/mol,反应是气体体积减小的吸热反应,
a.单位时间内生成1molN2同时生成2molNH3 ,说明咱反应速率相同,反应达到平衡状态,故a正确;
b.气体质量和体积不变,混合气体的密度始终保持不变,不能说明反应达到平衡状态,故b错误;
c.反应前后气体体积发生变化,体系中压强保持不变说明反应达到平衡状态,故c正确;
d.各物质的浓度之比为2:6;4:3是反应比等于化学方程式计量数之比,但不能说明反应达到平衡状态,故d错误;
故答案为:ac;
(3)某温度下,往一密闭容器中通入一定量的N2和H2O,反应前后气体体积减小,压强越大氮气物质的量越小,但反应速率大,达到平衡所需时间短,图象变化为: ,
,
故答案为: ;
;
(4)①2N2(g)+6H2O(g)?4NH3(g)+3O2(g)△H=akJ/mol,
②2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,
(①+②×3)×$\frac{1}{2}$得到合成氨的热化学方程式;N2(g)+3H2(g)=NH3(g)△H=(a-1452)KJ/mol,
故答案为:N2(g)+3H2(g)=NH3(g)△H=(a-1452)KJ/mol;
(5)500℃下,在一容积为1.0L的密闭容器中,通入0.60molN2和1.8molH2,反应在一定条件下达到平衡时,设消耗氮气物质的量为x,结三行计算列式,
N2(g)+3H2(g)=NH3(g)
起始量(mol) 0.60 1.80 0
变化量(mol) x 3x 2x
平衡量(mol)0.60-x 1.80-3x 2x
NH3的物质的量分数为20%,$\frac{2x}{0.60+1.80-2x}$=20%
x=0.2mol
此时N2的转化率=$\frac{0.2mol}{0.60mol}$×100%=33%,
答:此时N2的转化率33%.
点评 本题考查了化学平衡状态、化学反应速率、平衡计算和影响因素分析、热化学方程式书写等知识点,注意图象的绘制是依据化学平衡移动原理和反应特征进行,掌握基础是解题关键,题目难度中等.

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案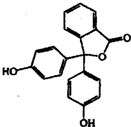 苯酚与邻苯二甲酸酐(
苯酚与邻苯二甲酸酐(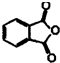 )在一定条件下反应可制得酚酞,酚酞的分子结构如图所示,下列说法正确的是( )
)在一定条件下反应可制得酚酞,酚酞的分子结构如图所示,下列说法正确的是( )| A. | 上述制酚酞的反应属于取代反应 | |
| B. | 酚酞分子中的碳原子有可能共处于同一平面 | |
| C. | 若与NaOH溶液反应.1mol酚酞最多可消耗4 molNaOH | |
| D. | 将酚酞溶于酒精配成的酚酞试剂.滴入中性或酸性水溶液中可能会出现白色浑浊 |
| 加入的物质 | 结论 | |
| A | 少量Ba(OH)2 | 反应结束后,c(CO32-)减小 |
| B | 再加入等量Na2CO3 | 溶液中c(CO32-)<c(HCO3-) |
| C | 100mLH2O | 由水电离出的c(H+)•c(OH-)不变 |
| D | 冰醋酸 | $\frac{c(C{O}_{3}^{2-})}{c(HC{{O}_{3}}^{-})}$增大 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 2:1 | B. | 1:2 | C. | 1:4 | D. | 3:1 |
(1)写出Na2S2O3与I2反应的离子方程式I2+2S2O32-=2I-+S4O62-.
(2)滴定中使用的指示剂是淀粉溶液,滴定终点的现象是蓝色溶液恰好变为无色且半分钟内不恢复.
(3)该小组同学的实验数据如下表:
| 实验序号 | 自来水的体积 | KI溶液的体积 | 消耗的Na2S2O3溶液的体积 |
| 1 | 10.00mL | 10.00mL | 19.96mL |
| 2 | 10.00mL | 10.00mL | 20.04mL |
(4)若实验中的锥形瓶用自来水洗净后未用蒸馏水洗涤,则实验值大于(填“大于、小于或等于”)实际值.
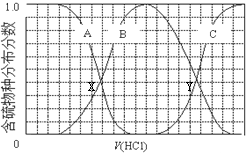
| A. | 含硫物种B表示HS- | |
| B. | 在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)] | |
| C. | X,Y为曲线的两交叉点,若能知道X点处的pH,就可以计算出H2S的Ka值 | |
| D. | NaHS呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是Cu2++HS-═CuS↓+H+ |
(1)基态砷原子的核外电子排布式为[Ar]3d104s24p3.氮、磷、砷的第一电离能顺序为N>P>As(填元素符号).
(2)已知N2O为直线形结构,结构式为N=N=O.则N2O是极性(填“极性”或“非极性”)分子.中间的氮原子的杂化轨道类型为sp杂化.
(3)已知下列数据:
| 物质 | 熔点/K | 沸点/K | 分解温度/K |
| NH3 | 195.3 | 239.7 | 1073 |
| PH3 | 139.2 | 185.4 | 713.2 |
(4)根据价层电子对互斥理论,氨分子中的键角<(填“>”、“<”或“=”)109°28′;PO43-离子的空间构型为正四面体.
(5)磷化铝的结构与金刚石相似,其结构单元如图所示:
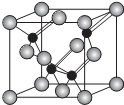
①经过计算,该晶体的化学式是AlP.
②该晶体中是(填“是”或“否”)存在配位键.

| A. | 25℃时①10-3mol/L的盐酸;②pH=3的NH4Cl溶液;③pH=11的氨水中,水的电离程度为:②>③>① | |
| B. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| C. | pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+) | |
| D. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+c(CH3COOH) |
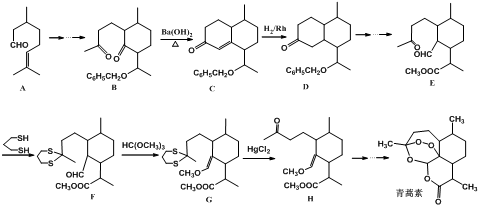
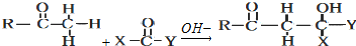
 CH2CH2CHO)的路线流程图.
CH2CH2CHO)的路线流程图.