题目内容
7.下列配制的溶液浓度偏高的是( )| A. | 配制盐酸溶液用量筒量取盐酸时,俯视刻度线 | |
| B. | NaOH溶解后未经冷却就注入容量瓶并定容至刻度线 | |
| C. | 称量11.7 g NaCl配制0.2 mol•L-1NaCl溶液1 000 mL时,砝码错放在左盘 | |
| D. | 配制盐酸溶液定容时,仰视容量瓶刻度线 |
分析 根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积是否有影响判断,如果n偏大或V偏小,则所配制溶液浓度偏高,据此分析解答.
解答 解:A.用量筒量取盐酸时俯视刻度线,所取盐酸的体积偏少,溶质的质量偏少,导致配制溶液的浓度偏低,故A错误;
B.NaOH溶解后未经冷却就注入容量瓶并定容至刻度线,冷却后液面下降,溶液体积偏小,溶液浓度偏高,故B正确;
C.称量11.7gNaCl固体时用到游码,砝码错放左盘,会导致所称量的NaCl固体的质量偏小,所配制溶液的浓度偏低,故C错误;
D.配制盐酸溶液定容时,仰视容量瓶刻度线,导致溶液体积偏大,溶液浓度偏低,故D错误;
故选:B.
点评 本题考查配制一定物质的量浓度的溶液的误差分析,题目难度中等,注意根据c=$\frac{n}{V}$分析不当操作对n或V的影响.

练习册系列答案
相关题目
14.由甲醇和乙醇组成的混合液体1.24g,加入足量的钠充分反应后,共产生标准状况下的气体336mL,则原混合物中甲醇和乙醇的物质的量之比为( )
| A. | 2:1 | B. | 1:2 | C. | 1:4 | D. | 3:1 |
18.氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.
(1)基态砷原子的核外电子排布式为[Ar]3d104s24p3.氮、磷、砷的第一电离能顺序为N>P>As(填元素符号).
(2)已知N2O为直线形结构,结构式为N=N=O.则N2O是极性(填“极性”或“非极性”)分子.中间的氮原子的杂化轨道类型为sp杂化.
(3)已知下列数据:
NH3的熔、沸点均高于PH3的原因是氨分子之间能形成氢键;PH3的分解温度高于其沸点,其原因是PH3分解需要破坏P-H键,PH3气化需要破坏分子间作用力,而化学键比分子间作用力强得多.
(4)根据价层电子对互斥理论,氨分子中的键角<(填“>”、“<”或“=”)109°28′;PO43-离子的空间构型为正四面体.
(5)磷化铝的结构与金刚石相似,其结构单元如图所示:

①经过计算,该晶体的化学式是AlP.
②该晶体中是(填“是”或“否”)存在配位键.
(1)基态砷原子的核外电子排布式为[Ar]3d104s24p3.氮、磷、砷的第一电离能顺序为N>P>As(填元素符号).
(2)已知N2O为直线形结构,结构式为N=N=O.则N2O是极性(填“极性”或“非极性”)分子.中间的氮原子的杂化轨道类型为sp杂化.
(3)已知下列数据:
| 物质 | 熔点/K | 沸点/K | 分解温度/K |
| NH3 | 195.3 | 239.7 | 1073 |
| PH3 | 139.2 | 185.4 | 713.2 |
(4)根据价层电子对互斥理论,氨分子中的键角<(填“>”、“<”或“=”)109°28′;PO43-离子的空间构型为正四面体.
(5)磷化铝的结构与金刚石相似,其结构单元如图所示:

①经过计算,该晶体的化学式是AlP.
②该晶体中是(填“是”或“否”)存在配位键.
15.铜的冶炼大致可分为:
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为2CuFeS2+4O2═Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为2Cu2S+3O2═2Cu2O+2SO2,2Cu2O+Cu2S═6Cu+SO2↑;
④电解精炼铜.
下列说法不正确( )
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为2CuFeS2+4O2═Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为2Cu2S+3O2═2Cu2O+2SO2,2Cu2O+Cu2S═6Cu+SO2↑;
④电解精炼铜.
下列说法不正确( )
| A. | 上述灼烧过程的尾气回收后可用来制硫酸 | |
| B. | 上述过程中,由6molCuFeS2制取6molCu时共消耗15molO2 | |
| C. | 在反应2Cu2O+Cu2S=6Cu+SO2↑中,氧化产物与还原产物的物质的量比1:6 | |
| D. | 在反应2Cu2O+Cu2S=6Cu+SO2↑中,只有Cu2O作氧化剂 |
12.由2个一CH3,3个-CH2-、1个 、1个-OH构成的有机物的数目为( )
、1个-OH构成的有机物的数目为( )
 、1个-OH构成的有机物的数目为( )
、1个-OH构成的有机物的数目为( )| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
19.室温下,关于下列溶液的说法正确的是( )


| A. | 25℃时①10-3mol/L的盐酸;②pH=3的NH4Cl溶液;③pH=11的氨水中,水的电离程度为:②>③>① | |
| B. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| C. | pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+) | |
| D. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+c(CH3COOH) |
16.化学与人类社会生产、生活密切相关,下列说法正确的是( )
| A. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 | |
| B. | 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2 | |
| C. | 陶瓷、砖瓦、玻璃、水泥等,都是硅酸盐产品 | |
| D. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
17.以甲醇为主要原料,电化学合成碳酸二甲酯工作原理如图所示.下列说法正确的是( )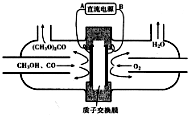

| A. | 外电源负极为A极 | |
| B. | 阳极的电极反应:2CH3OH+CO-2e-═(CH3O)2CO+2H+ | |
| C. | H+从右向左通过质子交换膜 | |
| D. | 电解槽中添加少量烧碱有利于导电 |

 ,请回答以下问题:
,请回答以下问题: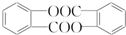 .
. 结构
结构 .
.