题目内容
16.解释下列事实的方程式不正确的是( )| A. | 次氯酸钙溶液中通人过量二氧化碳:ClO-+H2O+CO2=HCO3-+HClO | |
| B. | 硫酸型酸雨放置一段时间溶液的pH减小:2H2SO3+O2═2H2SO4 | |
| C. | 已知:Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H=+489.0kJ/mol CO(g)+$\frac{1}{2}$ O2(g)═CO2(g)△H=-283.0 kJ/mol C(s,石墨)+O2( g)═CO2(g)△H=-393.5kJ/mol 则4Fe(s))+3O2(g)═2Fe2O3(s)△H=-1641.0kJ/mol | |
| D. | 在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是:3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3•H2O |
分析 A.二氧化碳过量,反应生成碳酸氢钙;
B.亚硫酸不稳定易被氧化生成强酸硫酸;
C.利用盖斯定律来计算反应4Fe(s)+3O2(g)═Fe2O3(s)的反应热;
D.NH4Fe(SO4)2可以写成(NH4)2SO4•Fe2(SO4)3的形式,向NH4Fe(SO4)2溶液中加入Ba(OH)2溶液时,OH-先和Fe3+反应,再和NH4+反应,若发生3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3•H2O反应消耗3mol氨根离子则一定消耗3mol三价铁离子;
解答 解:A.次氯酸钙溶液中通入过量二氧化碳:ClO-+CO2+H2O=HCO3-+HClO,故A正确;
B.亚硫酸不稳定易被氧化生成强酸硫酸,方程式:2H2SO3+O2═2H2SO4,电离产生的氢离子浓度增大,pH变小,故B正确;
C.C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol ①,
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol ②,
Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H=+489.0kJ/mol ③,
根据盖斯定律,[①×3-②×3]×2-③×2得:4Fe(s)+3O2(g)═2Fe2O3(s),则△H=[3×(-393.5kJ/mol)-3×(-283kJ/mol)]×2-2×489.0kJ/mol=-1641.0kJ/mol,故C正确;
D.NH4Fe(SO4)2可以写成(NH4)2SO4•Fe2(SO4)3的形式,向NH4Fe(SO4)2溶液中加入Ba(OH)2溶液时,OH-先和Fe3+反应,再和NH4+反应,3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3•H2O若反应3mol氨根离子则三价铁离子完全反应,铁离子个数与铵根离子个数配比不符合物质结构,故D错误;
故D错误;
故选:D.
点评 本题考查了方程式的书写,涉及离子方程式、热化学方程式的书写等,明确盖斯定律计算反应热的方法是解题关键,注意离子反应中物质用量不同对反应产物的影响,题目难度中等.

| A. | 氧化铝属于合金的一种,有着广泛的用途 | |
| B. | 切过肉的菜刀比切过蔬菜的菜刀更耐腐蚀 | |
| C. | 铁是地壳中含量最高的金属,也是世界上年产量最高的金属 | |
| D. | 制作沉重的机床底座时应努力实现用纯铁替代钢 |
| A. | Al3+、NO3- | B. | Ba2+、Al3+、Cl- | C. | Ba2+、Al3+、NO3- | D. | Ag+、Al3+、NO3- |

| A. | ①和② | B. | ⑤和⑦ | C. | ④和⑥ | D. | ③和④ |
| A. | $\frac{a}{A+m}$(Z+m)mol 质子 | B. | $\frac{a}{A}$(Z+m)mol 电子 | ||
| C. | $\frac{a}{A+m}$(A-Z+m)mol 中子 | D. | $\frac{a}{A}$mmolHmX |
| A. | 微粒半径:K>Ca>H | B. | 碱性强弱:Mg(OH)2>Ca(OH)2>Ba(OH)2 | ||
| C. | 最高化合价:F>N>Si | D. | 热稳定性:HF>H2S>H2O |
(1)选择试剂以除去下表所列的可溶性杂质
| 杂质 | 加入的试剂 |
| 硫酸盐 | ①BaCl2 |
| MgCl2 | ②NaOH |
| CaCl2 | ③Na2CO3 |
(3)最后加适量的盐酸以调节溶液至中性并除去过量的CO32-,其中盐酸除去CO32-的离子方程式为CO32-+2H+=H2O+CO2↑.
(4)最后蒸发结晶操作时,玻璃棒的作用是搅拌,防止局部过热使液体飞测;,当看到有大量固体析出,或者仅余少量液体时时,应停止加热,用余热蒸干.
| A. | 中子数为18的氯原子可表示为18Cl | B. | F-离子结构示意图 | ||
| C. | 用电子式表示HCl形成过程 | D. | 次氯酸电子式 |
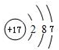 ,写出化合物E2B2的电子式
,写出化合物E2B2的电子式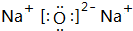 ,C在周期表中的位置第三周期VIA族.
,C在周期表中的位置第三周期VIA族.