题目内容
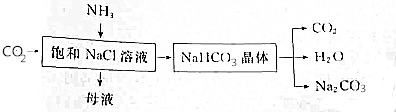
2.进行粗盐精制时,需要用化学方法除去杂质.试回答下列问题:(1)选择试剂以除去下表所列的可溶性杂质
| 杂质 | 加入的试剂 |
| 硫酸盐 | ①BaCl2 |
| MgCl2 | ②NaOH |
| CaCl2 | ③Na2CO3 |
(3)最后加适量的盐酸以调节溶液至中性并除去过量的CO32-,其中盐酸除去CO32-的离子方程式为CO32-+2H+=H2O+CO2↑.
(4)最后蒸发结晶操作时,玻璃棒的作用是搅拌,防止局部过热使液体飞测;,当看到有大量固体析出,或者仅余少量液体时时,应停止加热,用余热蒸干.
分析 从电离的角度分析粗盐中的杂质可知:溶液中的杂质离子为硫酸根离子、镁离子、和钙离子,硫酸根离子用钡离子沉淀,根据镁离子用氢氧根离子沉淀,钙离子用碳酸根离子沉淀,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析.蒸发结晶操作时玻璃棒的作用是搅拌,防止局部过热使液体飞测.
解答 解:(1)为了不引入新的杂质,①加入过量BaCl2溶液,可除掉硫酸根离子,②加入过量NaOH溶液,可除掉镁离子,③加入过量Na2CO3溶液,可除掉钙离子;
故答案为:②NaOH ③Na2CO3;
(2)③中加入过量Na2CO3溶液不仅为了完全除去Ca2+,还可以将过量的钡离子沉淀,对氢氧化钠而言没有顺序要求,但碳酸钠要放在氯化钡之后,所以②③可以换顺序;
故答案为:②③; ③②;
(3)最后加适量的盐酸以调节溶液至中性并除去过量的CO32-,在除掉碳酸根、氢氧根后,得到氯化钠溶液,呈中性,氢离子与碳酸根反应生成二氧化碳和水;
故答案为:CO32-+2H+=H2O+CO2↑;
(4)蒸发结晶在蒸发皿中进行,蒸发皿放于铁架台的铁圈上,倒入液体不超过蒸发皿容积的2/3,加热时不断用玻璃棒搅拌液体防止受热不均,液体飞溅.看到有大量固体析出,或者仅余少量液体时,停止加热,利用余热将液体蒸干;
故答案为:搅拌,防止局部过热使液体飞测;看到有大量固体析出,或者仅余少量液体时.
点评 除杂问题是化学实验中的一类重要问题,除杂时不仅要能把杂质除掉,还不能引入新杂质,而且方法要简便易行,把握好此原则需要我们有扎实的基础知识和缜密的思维.

练习册系列答案
相关题目
15.有A、B、C、D、E五种元素,其相关信息如下:
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p6sd104s1.
(2)C元素的第一电离能比氧元素的第一电离能大(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是sp3,其在水中溶解度大,理由:NH3与H2O分子间形成氢键
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有①③(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
1mol[E(CA3)4]2+中含有σ键的数目为16mol.
| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
(2)C元素的第一电离能比氧元素的第一电离能大(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是sp3,其在水中溶解度大,理由:NH3与H2O分子间形成氢键
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有①③(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
1mol[E(CA3)4]2+中含有σ键的数目为16mol.
16.解释下列事实的方程式不正确的是( )
| A. | 次氯酸钙溶液中通人过量二氧化碳:ClO-+H2O+CO2=HCO3-+HClO | |
| B. | 硫酸型酸雨放置一段时间溶液的pH减小:2H2SO3+O2═2H2SO4 | |
| C. | 已知:Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H=+489.0kJ/mol CO(g)+$\frac{1}{2}$ O2(g)═CO2(g)△H=-283.0 kJ/mol C(s,石墨)+O2( g)═CO2(g)△H=-393.5kJ/mol 则4Fe(s))+3O2(g)═2Fe2O3(s)△H=-1641.0kJ/mol | |
| D. | 在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是:3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3•H2O |
13.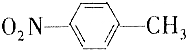 和
和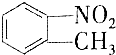 的一些物理性质如下表所示:
的一些物理性质如下表所示:
(1)分离这两种物质的混合物可采用的方法是D(填字母).
A.过滤 B.分液 C.蒸发 D.分馏
(2)实验需要用到的主要玻璃仪器是蒸馏烧瓶、酒精灯、温度计、冷凝管以及锥形瓶.
 和
和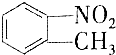 的一些物理性质如下表所示:
的一些物理性质如下表所示:| 物质 | 熔点 | 沸点 | 密度 | 水溶性 |
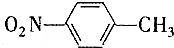 | -10℃ | 212℃ | 1.1622g/cm3 | 不溶于水 |
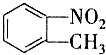 | 54℃ | 238℃ | 1.1581g/cm3 | 不溶于水 |
A.过滤 B.分液 C.蒸发 D.分馏
(2)实验需要用到的主要玻璃仪器是蒸馏烧瓶、酒精灯、温度计、冷凝管以及锥形瓶.
7.A是一种含碳、氢、氧三种元素的有机化合物.已知:A中碳的质量分数为52.16%,氢的质量分数为13.14%,那么A的实验式是( )
| A. | C2H6O | B. | CH3O | C. | C4H12O2 | D. | C5H10O4 |
11.下表是周期表中的一部分,根据A~I在周期表中的位置,用相对应的元素符号或化学式 回答下列问题.
表中元素,原子半径最小的是H,原子半径最大的是Na化学性质最不活泼的是Ne,氧化性最强的单质是F2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | H | |||||||
| 二 | C | N | F | Ne | ||||
| 三 | Na | Al | P | S |
12.两种气态烃以任意比例混合,在105℃时lL该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L,下列各组混合烃中符合此条件的是( )
| A. | CH4 C2H6 | B. | C2H4 C3H6 | C. | C2H4 C3H4 | D. | C2H6 C3H6 |
 .
.