题目内容
7.某溶液由Na+、Ag+、Ba2+、Al3+、AlO2-、Fe2+、NO3-、Cl-、SO42-中若干种组成,现将溶液分成两等份,再分别通入足量的NH3和SO2充分反应后,最终均有白色沉淀生成.则溶液中一定含有的离子有( )| A. | Al3+、NO3- | B. | Ba2+、Al3+、Cl- | C. | Ba2+、Al3+、NO3- | D. | Ag+、Al3+、NO3- |
分析 分成两等份,再分别通入足量的NH3和SO2充分反应后,最终均有白色沉淀生成,因Ag+与足量氨水反应生成络离子,Al3+与氨水反应生成白色沉淀,Fe2+与氨水反应生成氢氧化亚铁最终转化为红褐色沉淀;
另一份中,NO3-、SO2发生氧化还原反应生成SO42-,SO42-与Ag+或Ba2+结合生成白色沉淀,以此来解答.
解答 解:分成两等份,再分别通入足量的NH3和SO2充分反应后,最终均有白色沉淀生成,因Ag+与足量氨水反应生成络离子,Al3+与氨水反应生成白色沉淀,Fe2+与氨水反应生成氢氧化亚铁最终转化为红褐色沉淀;
另一份中,NO3-、SO2发生氧化还原反应生成SO42-,SO42-与Ag+或Ba2+结合生成白色沉淀,
综上所述,一定含Al3+、NO3-,Ag+、Ba2+至少含一种,一定不含AlO2-、Fe2+,
不能确定是否含SO42-、Na+、Cl-,
故选A.
点评 本题考查常见离子的检验,为高频考点,把握常见离子之间的反应、白色沉淀的判断为解答的关键,侧重分析与推断能力的综合考查,充分考查了学生灵活应用基础知识的能力,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.化学反应:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1<0
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2<0
C(s)+O2(g)═CO2(g)△H3<0;
下列说法中不正确的是(相同条件下)( )
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2<0
C(s)+O2(g)═CO2(g)△H3<0;
下列说法中不正确的是(相同条件下)( )
| A. | 56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量 | |
| B. | 12 g C所具有的能量一定大于28 g CO所具有的能量 | |
| C. | △H1+△H2=△H3 | |
| D. | 将两份质量相等的碳燃烧,生成CO2的反应比生成CO的反应放出的热量多 |
18.下表中的数据表示破坏1mol化学键需消耗的能量:根据下表数据计算以下反应生成1mol CO2时的热量变化( )
CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g)+2H2O(g)
CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g)+2H2O(g)
| 化 学 键 | C-H | O-O | O=O | C-O | C=O | H-O |
| 能量 (kJ) | 415 | 138 | 498 | 343 | 798 | 465 |
| A. | 放出热量800 kJ | B. | 放出热量1520 kJ | C. | 吸收热量110 kJ | D. | 放出热量610 kJ |
15.有A、B、C、D、E五种元素,其相关信息如下:
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p6sd104s1.
(2)C元素的第一电离能比氧元素的第一电离能大(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是sp3,其在水中溶解度大,理由:NH3与H2O分子间形成氢键
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有①③(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
1mol[E(CA3)4]2+中含有σ键的数目为16mol.
| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
(2)C元素的第一电离能比氧元素的第一电离能大(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是sp3,其在水中溶解度大,理由:NH3与H2O分子间形成氢键
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有①③(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
1mol[E(CA3)4]2+中含有σ键的数目为16mol.
2.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
| A. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 | |
| B. | 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性 | |
| C. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| D. | X、Y、Z三种元素氢化物的沸点依次升高 |
19.试推断,82号元素位于周期表中的( )
| A. | 第6周期、VIA族 | B. | 第7周期、ⅥA族 | C. | 第6周期、IVA族 | D. | 第7周期、IVA族 |
16.解释下列事实的方程式不正确的是( )
| A. | 次氯酸钙溶液中通人过量二氧化碳:ClO-+H2O+CO2=HCO3-+HClO | |
| B. | 硫酸型酸雨放置一段时间溶液的pH减小:2H2SO3+O2═2H2SO4 | |
| C. | 已知:Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H=+489.0kJ/mol CO(g)+$\frac{1}{2}$ O2(g)═CO2(g)△H=-283.0 kJ/mol C(s,石墨)+O2( g)═CO2(g)△H=-393.5kJ/mol 则4Fe(s))+3O2(g)═2Fe2O3(s)△H=-1641.0kJ/mol | |
| D. | 在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是:3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3•H2O |
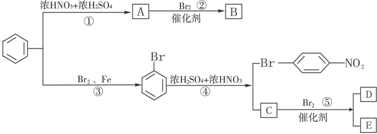
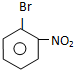 .
. ,E为
,E为 .
. .
.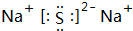 .
.