题目内容
1.下列各组排列顺序,正确的是( )| A. | 微粒半径:K>Ca>H | B. | 碱性强弱:Mg(OH)2>Ca(OH)2>Ba(OH)2 | ||
| C. | 最高化合价:F>N>Si | D. | 热稳定性:HF>H2S>H2O |
分析 A.电子层越多,原子半径越大,同周期原子序数大的原子半径小;
B.金属性越强,最高价氧化物的水化物碱性越强;
C.F无正价;
D.非金属性越强,对应氢化物越稳定.
解答 解:A.电子层越多,原子半径越大,同周期原子序数大的原子半径小,则微粒半径:K>Ca>H,故A正确;
B.金属性Ba>Ca>Mg,最高价氧化物的水化物碱性为Mg(OH)2<Ca(OH)2<Ba(OH)2,故B错误;
C.F无正价,最高化合价:N>Si,故C错误;
D.非金属性F>O>S,对应氢化物热稳定性:HF>H2O>H2S,故D错误;
故选A.
点评 本题考查周期表和周期律的应用,为高频考点,侧重于分析与应用能力的考查,把握元素的位置和性质、元素周期律等为解答该题的关键,题目难度不大.

练习册系列答案
相关题目
11.某化合物的结构(键线式)图1及球棍模型如图2如下:

该有机分子的核磁共振氢谱图如图3下(单位是ppm)下列关于该有机物的叙述,不正确的是( )

该有机分子的核磁共振氢谱图如图3下(单位是ppm)下列关于该有机物的叙述,不正确的是( )
| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH2CH3 | |
| D. | 1 mol 该有机物完全燃烧可以产生 6 mol水 |
9.某元素原子结构示意图为 ,该原子( )
,该原子( )
 ,该原子( )
,该原子( )| A. | 核电荷数为32 | B. | 核外电子数为16 | C. | 最外层电子数为6 | D. | 核外电子层数为3 |
16.解释下列事实的方程式不正确的是( )
| A. | 次氯酸钙溶液中通人过量二氧化碳:ClO-+H2O+CO2=HCO3-+HClO | |
| B. | 硫酸型酸雨放置一段时间溶液的pH减小:2H2SO3+O2═2H2SO4 | |
| C. | 已知:Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H=+489.0kJ/mol CO(g)+$\frac{1}{2}$ O2(g)═CO2(g)△H=-283.0 kJ/mol C(s,石墨)+O2( g)═CO2(g)△H=-393.5kJ/mol 则4Fe(s))+3O2(g)═2Fe2O3(s)△H=-1641.0kJ/mol | |
| D. | 在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是:3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3•H2O |
13.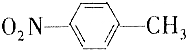 和
和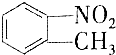 的一些物理性质如下表所示:
的一些物理性质如下表所示:
(1)分离这两种物质的混合物可采用的方法是D(填字母).
A.过滤 B.分液 C.蒸发 D.分馏
(2)实验需要用到的主要玻璃仪器是蒸馏烧瓶、酒精灯、温度计、冷凝管以及锥形瓶.
 和
和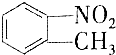 的一些物理性质如下表所示:
的一些物理性质如下表所示:| 物质 | 熔点 | 沸点 | 密度 | 水溶性 |
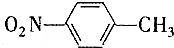 | -10℃ | 212℃ | 1.1622g/cm3 | 不溶于水 |
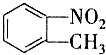 | 54℃ | 238℃ | 1.1581g/cm3 | 不溶于水 |
A.过滤 B.分液 C.蒸发 D.分馏
(2)实验需要用到的主要玻璃仪器是蒸馏烧瓶、酒精灯、温度计、冷凝管以及锥形瓶.
7.A是一种含碳、氢、氧三种元素的有机化合物.已知:A中碳的质量分数为52.16%,氢的质量分数为13.14%,那么A的实验式是( )
| A. | C2H6O | B. | CH3O | C. | C4H12O2 | D. | C5H10O4 |
8.下列说法中不正确的是( )
| A. | 电子数相同的粒子不一定属于同种元素 | |
| B. | 两个原子如果核外电子排布相同,一定属于同种元素 | |
| C. | 质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子 | |
| D. | 所含质子数和电子数相等的粒子一定是原子 |

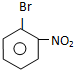 .
. ,E为
,E为 .
. .
.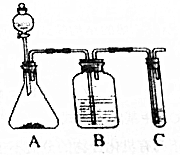 利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.
利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.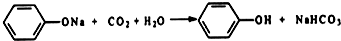 ;
;