题目内容
3.下列各项中表达正确的是( )| A. | 中子数为18的氯原子可表示为18Cl | B. | F-离子结构示意图 | ||
| C. | 用电子式表示HCl形成过程 | D. | 次氯酸电子式 |
分析 A.元素符号的左上角为质量数,该氯原子的质量数=17+18=35;
B.氟离子的核电荷数为9,核外电子总数为10;
C.氯化氢为共价化合物,不存在阴阳离子;
D.次氯酸的中心原子为O原子,分子中不存在H-Cl键.
解答 解:A.中子数为18的氯原子的质量数为35,其正确的表示方法为:1735Cl,故A错误;
B.F-离子的最外层满足8电子稳定结构,其离子结构示意图为: ,故B正确;
,故B正确;
C.氯化氢为共价化合物,分子中不存在阴阳离子,正确的氯化氢形成过程为 ,故C错误;
,故C错误;
D.次氯酸为共价化合物,分子中不存在氢氯键,次氯酸的电子式为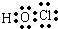 ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、离子结构示意图、元素符号的表示方法等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
16.解释下列事实的方程式不正确的是( )
| A. | 次氯酸钙溶液中通人过量二氧化碳:ClO-+H2O+CO2=HCO3-+HClO | |
| B. | 硫酸型酸雨放置一段时间溶液的pH减小:2H2SO3+O2═2H2SO4 | |
| C. | 已知:Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H=+489.0kJ/mol CO(g)+$\frac{1}{2}$ O2(g)═CO2(g)△H=-283.0 kJ/mol C(s,石墨)+O2( g)═CO2(g)△H=-393.5kJ/mol 则4Fe(s))+3O2(g)═2Fe2O3(s)△H=-1641.0kJ/mol | |
| D. | 在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是:3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3•H2O |
11.下表是周期表中的一部分,根据A~I在周期表中的位置,用相对应的元素符号或化学式 回答下列问题.
表中元素,原子半径最小的是H,原子半径最大的是Na化学性质最不活泼的是Ne,氧化性最强的单质是F2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | H | |||||||
| 二 | C | N | F | Ne | ||||
| 三 | Na | Al | P | S |
18.下列液体混合物中可以用分液漏斗进行分离,且操作时水从分液漏斗的下口流出来的一组是( )
| A. | 苯和水 | B. | 酒精和水 | C. | 溴苯和水 | D. | 硝基苯和水 |
8.下列说法中不正确的是( )
| A. | 电子数相同的粒子不一定属于同种元素 | |
| B. | 两个原子如果核外电子排布相同,一定属于同种元素 | |
| C. | 质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子 | |
| D. | 所含质子数和电子数相等的粒子一定是原子 |
15.对物质进行科学分类,有利于把物质本质属性和物质间内在联系,以下关于物质的分类正确的是( )
| 氧化物 | 酸 | 碱 | 盐 | |
| A | Fe3O4 | CH3COOH | NH3•H2O | (NH4)2SO 4 |
| B | SO2 | H2SO4 | NaOH | Na2O2 |
| C | CO | HNO3 | Cu2(OH)2CO3 | FeSO4 |
| D | H2O | NaHSO4 | Ba(OH)2 | Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
12.两种气态烃以任意比例混合,在105℃时lL该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L,下列各组混合烃中符合此条件的是( )
| A. | CH4 C2H6 | B. | C2H4 C3H6 | C. | C2H4 C3H4 | D. | C2H6 C3H6 |
 .
.

 .
. .
. (任写一种)
(任写一种)