题目内容
 根据信息回答列问题:
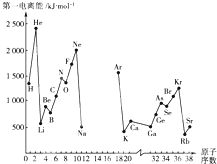
根据信息回答列问题:A.第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量.下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失).
B.不同元素的原子在分子内吸电子的能力大小可用数值表示,该数值称为电负性.一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键.下表是某些元素的电负性值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)从A图分析可知,同一主族元素原子的第一电离能I1变化规律是
(3)A图中第一电离能最小的元素在周期表中的位置是
(4)根据对角线规则,Be、Al元素最高价氧化物对应水化物的性质相似,它们都具有
(5)通过分析电负性值变化规律,确定Mg元素电负性值的最小范围
(6)请归纳元素的电负性和金属、非金属的关系是
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物?请说出理由(即写出判断的方法和结论)是
请设计一个实验方案证明上述所得到的结论
考点:元素电离能、电负性的含义及应用,原子结构与元素周期律的关系
专题:
分析:(1)由图可知第ⅡA、ⅤA族元素的第一电离能有突变,因此Al的第一电离能的最小范围为Na<Al<Mg.
(2)同一主族元素原子的第一电离能I1变化规律是从上到下逐渐减小.
(3)图中第一电离能最小的元素是铷,在第五周期ⅠA族.
(4)Be(OH)2、Al(OH)3均为两性氢氧化物;
(5)运用电负性的递变规律:同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小;
(6)电负性与元素性质的关系:非金属性越强,电负性越大,金属性越强,电负性越小;
(7)注意判断共价化合物的依据:两元素的电负性差值若小于1.7,形成共价键;若电负性的差值大于1.7,则形成离子键.
(2)同一主族元素原子的第一电离能I1变化规律是从上到下逐渐减小.
(3)图中第一电离能最小的元素是铷,在第五周期ⅠA族.
(4)Be(OH)2、Al(OH)3均为两性氢氧化物;
(5)运用电负性的递变规律:同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小;
(6)电负性与元素性质的关系:非金属性越强,电负性越大,金属性越强,电负性越小;
(7)注意判断共价化合物的依据:两元素的电负性差值若小于1.7,形成共价键;若电负性的差值大于1.7,则形成离子键.
解答:
解:(1)由图可知第ⅡA、ⅤA族元素的第一电离能有突变,因此Al的第一电离能的最小范围为Na<Al<Mg,故答案为:Na;Mg.
(2)同一主族元素原子的从上到下,金属性增强,容易失去电子,所以第一电离能I1变化规律是从上到下逐渐减小,故答案为:从上到下依次减小;
(3)金属性越强,越容易失去电子,所以第一电离能越小,图中第一电离能最小的元素是铷,在第五周期ⅠA族,故答案为:五;ⅠA;
(4)Be(OH)2、Al(OH)3均为两性氢氧化物,都能与酸反应生成盐和水,也都能与强碱反应生成盐和水,其中Be(OH)2显示这种性质的离子方程式是Be(OH)2+2H+=Be2++2H2O、Be(OH)2+2OH-=BeO2-+2H2O;故答案为:两;Be(OH)2+2H+=Be2++2H2O;
(5)根据电负性的递变规律:同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,可知,在同周期中电负性Na<Mg<Al,同主族Be>Mg>Ca,最小范围应为0.93~1.57.故答案为:0.93~1.57;
(6)因电负性可以用来衡量原子吸引电子能力的大小,所以电负性越大,原子吸引电子的能力越强,非金属性越强,反之金属性越强.故答案为:非金属性越强,电负性越大,金属性越强,电负性越小;
(7)AlCl3中Al与Cl的电负性差值为1.55,根据信息,电负性差值若小于1.7,则形成共价键,所以AlCl3为共价化合物.离子化合物在熔融状态下以离子形式存在,可以导电,但共价化合物不能导电,
故答案为:Al元素和Cl元素的电负性差值为1.55<1.7,所以形成共价键,为共价化合物;将氯化铝加热到熔融态,进行导电性实验,如果不导电,说明是共价化合物.
(2)同一主族元素原子的从上到下,金属性增强,容易失去电子,所以第一电离能I1变化规律是从上到下逐渐减小,故答案为:从上到下依次减小;
(3)金属性越强,越容易失去电子,所以第一电离能越小,图中第一电离能最小的元素是铷,在第五周期ⅠA族,故答案为:五;ⅠA;
(4)Be(OH)2、Al(OH)3均为两性氢氧化物,都能与酸反应生成盐和水,也都能与强碱反应生成盐和水,其中Be(OH)2显示这种性质的离子方程式是Be(OH)2+2H+=Be2++2H2O、Be(OH)2+2OH-=BeO2-+2H2O;故答案为:两;Be(OH)2+2H+=Be2++2H2O;
(5)根据电负性的递变规律:同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,可知,在同周期中电负性Na<Mg<Al,同主族Be>Mg>Ca,最小范围应为0.93~1.57.故答案为:0.93~1.57;
(6)因电负性可以用来衡量原子吸引电子能力的大小,所以电负性越大,原子吸引电子的能力越强,非金属性越强,反之金属性越强.故答案为:非金属性越强,电负性越大,金属性越强,电负性越小;
(7)AlCl3中Al与Cl的电负性差值为1.55,根据信息,电负性差值若小于1.7,则形成共价键,所以AlCl3为共价化合物.离子化合物在熔融状态下以离子形式存在,可以导电,但共价化合物不能导电,
故答案为:Al元素和Cl元素的电负性差值为1.55<1.7,所以形成共价键,为共价化合物;将氯化铝加热到熔融态,进行导电性实验,如果不导电,说明是共价化合物.
点评:本题考查了第一电离能的变化趋势,难度不大,注意“同一周期元素中,元素第一电离能的变化趋势,及异常现象”,为易错点.

练习册系列答案
相关题目
如图甲池和乙池中的四个电极都是惰性材料,请根据图示判断下列说法正确的是( )


| A、甲池中,b电极是负极 |
| B、a电极的电极反应式C2H5OH+16OH--12e-=2CO32-+11H2O |
| C、一段时间后,用湿润淀粉KI试纸靠近乙池d电极变蓝放电 |
| D、乙池在反应前后溶液的pH不变 |
在下列物质中,化合物类型相同的一组是( )
| A、NaCl HCl |
| B、CO2 H2O |
| C、H2CO3 KCl |
| D、MgCl2 SO2 |
硬铝的主要成分是( )
| A、纯铝 | B、钢化玻璃 |
| C、沙子 | D、镁铝合金 |
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF下列有关该反应的说法正确的是( )
| A、NF3是氧化剂,H2O是还原剂 |
| B、还原剂和氧化剂的物质的量之比是2:1 |
| C、若生成0.2mol HNO3,则转移0.4mol电子 |
| D、NF3在潮湿的空气中泄漏会产生红棕色气体 |
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O═2NO+HNO3+9HF,下列有关该反应的说法正确的是( )
| A、NF3是氧化剂,H2O是还原剂 |
| B、还原剂和氧化剂的物质的量之比为2:1 |
| C、若生成0.2mol HNO3,则转移0.4mol电子 |
| D、按照树状分类法的分类原则,NF3属于盐 |
下列解释事实的离子方程式不正确的是( )
| A、Fe能溶于FeCl3溶液:Fe+Fe3+═2Fe2+ |
| B、Cl2的氧化性强于Br2:Cl2+2Br-═2Cl-+Br2 |
| C、Na与H2O反应产生气体:2Na+2H2O═2Na++2OH-+H2↑ |
| D、Na2SiO3溶液与盐酸反应生成硅酸凝胶:SiO32-+2H+═H2SiO3(胶体) |