题目内容
我国《车用燃料甲醇国家标准》的实施拉开了车用燃料低碳革命的大幕,一些省市正在陆续试点与推广使用甲醇汽油.甲醇可通过CO和H2在一定条件下发生如下反应制得:CO(g)+2H2(g)?CH3OH(g) 图Ⅰ、图Ⅱ是关于该反应进行情况的图示.
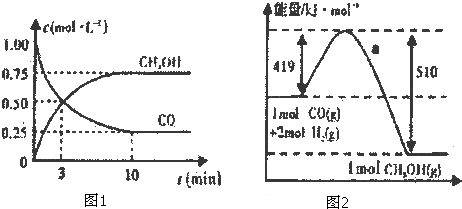
请根据图示回答下列问题:
(l)图I是反应时CO和CH3OH的浓度随时间的变化情况,从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)= .
(2)图Ⅱ表示该反应进行过程中能量的变化,曲线a表示不使用催化剂时反应的能量变化,在图Ⅱ中画出使用催化剂后的能量变化曲线b.
(3)写出该反应的热化学方程式 .
(4)该反应的平衡常数K的表达式为 ;当温度升高时,该平衡常
数K将 (填“增大”、“减小”或“不变”).
(5)恒容条件下,下列措施中能使
增大的有 .
A.升高温度 B.充入He气C.再充入l mol CO和2molH2 D.使用催化剂
(6)若在一体积可变的密闭容器中充入l molCO、2mol H2和l mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向 (填“正”、“逆”)反应方向移动,理由是 .

请根据图示回答下列问题:
(l)图I是反应时CO和CH3OH的浓度随时间的变化情况,从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=
(2)图Ⅱ表示该反应进行过程中能量的变化,曲线a表示不使用催化剂时反应的能量变化,在图Ⅱ中画出使用催化剂后的能量变化曲线b.
(3)写出该反应的热化学方程式
(4)该反应的平衡常数K的表达式为
数K将
(5)恒容条件下,下列措施中能使
| n(CH3OH) |
| n(CO) |
A.升高温度 B.充入He气C.再充入l mol CO和2molH2 D.使用催化剂
(6)若在一体积可变的密闭容器中充入l molCO、2mol H2和l mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素
专题:化学平衡专题
分析:(1)根据图I时,反应中CO浓度的变化,结合速率公式计算;
(2)根据催化剂对活化能的影响分析;
(3)根据反应物与生成物的总能量来分析吸热还是放热,并书写热化学反应方程式;
(4)根据反应方程式结合平衡常数的含义书写;根据温度对平衡的影响分析K的变化;
(5)恒容条件下,下列措施中能使
增大,则平衡正移,据此分析;
(6)同温同压下,混合气体的密度与摩尔质量成正比,如果平衡不移动,密度应相等,据此分析.
(2)根据催化剂对活化能的影响分析;
(3)根据反应物与生成物的总能量来分析吸热还是放热,并书写热化学反应方程式;
(4)根据反应方程式结合平衡常数的含义书写;根据温度对平衡的影响分析K的变化;
(5)恒容条件下,下列措施中能使
| n(CH3OH) |
| n(CO) |
(6)同温同压下,混合气体的密度与摩尔质量成正比,如果平衡不移动,密度应相等,据此分析.
解答:
解:(1)由图I可知,反应中CO浓度的变化为:1.00-0.25=0.75mol?L-1,则c(CO)=
=
=0.075mol/(L?min),故答案为:0.075mol/(L?min);
(2)图Ⅱ表示该反应进行过程中能量的变化,曲线a表示不使用催化剂时反应的能量变化,使用催化剂后反应的活化能降低,则能量变化曲线b如图: ,故答案为:
,故答案为: ;
;
(3)反应物的总能量为419kJ,生成物的总能量为510kJ,则该反应为放热反应,放出的热量为419kJ-510kJ=91kJ,热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol,
故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol;
(4)已知CO(g)+2H2(g)?CH3OH(g);则K=
;已知该反应的正方向为放热反应,升高温度平衡逆移,所以K减小;
故答案为:K=
;减小;
(5)恒容条件下,下列措施中能使
增大,则平衡正移;
A.已知该反应的正方向为放热反应,升高温度,平衡逆移,故A错误;
B.充入He气,容器的体积不变,各反应物的浓度不变,平衡不移动,故B错误;
C.再充入1molCO和2molH2,与原来加入了的量等比例,平衡时比原来的平衡的压强增大,平衡正移,故C正确;
D.使用催化剂,同等程度的改变正逆反应速率,平衡不移动,故D错误;
故答案为:C;
(6)同温同压下,混合气体的密度与摩尔质量成正比,如果平衡不移动,密度应相等,现在密度是原来的1.6倍,所以平衡向气体计量数减小的方向移动,
故答案为:正;该反应前后气体总质量不变,同温同压下达平衡时气体密度增大,即气体体积缩小,反应正向进行.
| △c |
| △t |
| 0.75mol |
| 10min |
(2)图Ⅱ表示该反应进行过程中能量的变化,曲线a表示不使用催化剂时反应的能量变化,使用催化剂后反应的活化能降低,则能量变化曲线b如图:
 ,故答案为:
,故答案为: ;
;(3)反应物的总能量为419kJ,生成物的总能量为510kJ,则该反应为放热反应,放出的热量为419kJ-510kJ=91kJ,热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol,
故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol;
(4)已知CO(g)+2H2(g)?CH3OH(g);则K=
| c(CH3OH) |
| c(CO)?c2(H2) |
故答案为:K=
| c(CH3OH) |
| c(CO)?c2(H2) |
(5)恒容条件下,下列措施中能使
| n(CH3OH) |
| n(CO) |
A.已知该反应的正方向为放热反应,升高温度,平衡逆移,故A错误;
B.充入He气,容器的体积不变,各反应物的浓度不变,平衡不移动,故B错误;
C.再充入1molCO和2molH2,与原来加入了的量等比例,平衡时比原来的平衡的压强增大,平衡正移,故C正确;
D.使用催化剂,同等程度的改变正逆反应速率,平衡不移动,故D错误;
故答案为:C;
(6)同温同压下,混合气体的密度与摩尔质量成正比,如果平衡不移动,密度应相等,现在密度是原来的1.6倍,所以平衡向气体计量数减小的方向移动,
故答案为:正;该反应前后气体总质量不变,同温同压下达平衡时气体密度增大,即气体体积缩小,反应正向进行.
点评:本题为综合性习题,考查影响化学平衡的因素、热化学反应、化学平衡常数、反应速率的计算,图象的分析和利用等知识点,注重对高考热点知识的考查,是较好的习题.

练习册系列答案
相关题目
下列说法不正确的是( )
A、有机物B与 (M1=142.5)互为相邻同系物,则M(B)可能为128.5 (M1=142.5)互为相邻同系物,则M(B)可能为128.5 |
B、最简单的醛糖是甘油醛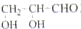 |
| C、苯和苯甲酸的混合物1mol,完全燃烧消耗O2的分子数为7.5NA |
| D、乙苯能被酸性KMnO4溶液氧化,是因为苯环对侧链上的-CH2-产生了影响,使其变活泼 |
如图所示的装置最适宜于干燥、收集的气体是( )


| A、NO |
| B、HC1 |
| C、NO2 |
| D、NH3 |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、0.1 mol?L-1醋酸溶液中离子总数为0.2NA |
| B、T℃时,pH=6的纯水中,含10-8NA个OH- |
| C、25℃时,1L pH=13的氢氧化钠溶液中含有0.1NA氢氧根离子 |
| D、1L 0.1 mol?L-1的硫化钠溶液中硫离子数目为0.1NA |
除去KNO3溶液中的少量Ca(NO3)2杂质,可以使用的方法为( )
| A、加入过量的Na2CO3溶液,过滤除去沉淀,所得溶液中补加适量稀HNO3 |
| B、加入过量的KCl溶液,过滤除去沉淀,所得溶液中补加适量稀HNO3 |
| C、加入过量的K2CO3溶液,过滤除去沉淀,所得溶液中补加适量稀HNO3 |
| D、加入过量的NaCl溶液,过滤除去沉淀,所得溶液中补加适量稀HNO3 |
 根据信息回答列问题:
根据信息回答列问题: