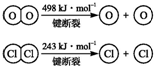
题目内容
如图甲池和乙池中的四个电极都是惰性材料,请根据图示判断下列说法正确的是( )


| A、甲池中,b电极是负极 |
| B、a电极的电极反应式C2H5OH+16OH--12e-=2CO32-+11H2O |
| C、一段时间后,用湿润淀粉KI试纸靠近乙池d电极变蓝放电 |
| D、乙池在反应前后溶液的pH不变 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A、燃料电池是原电池,通入燃料的电极是负极;
B、C2H5OH在碱性条件下失电子生成碳酸盐;
C、乙池为电解池,d为阴极,氢离子得电子,c为阳极,氯离子失电子;
D、乙池中为惰性电极电解氯化钠溶液.
B、C2H5OH在碱性条件下失电子生成碳酸盐;
C、乙池为电解池,d为阴极,氢离子得电子,c为阳极,氯离子失电子;
D、乙池中为惰性电极电解氯化钠溶液.
解答:
解:A、燃料电池是原电池,通入燃料的电极是负极,即通入乙醇的一极为负极,则a为负极,故A错误;
B、C2H5OH在碱性条件下放电生成碳酸盐,方程式为:C2H5OH+16OH--12e-═2CO32-+11H2O,故B正确;
C、乙池为电解池,d为阴极,氢离子得电子,c为阳极,氯离子失电子,则在c极附近生成氯气,故用湿润淀粉KI试纸靠近乙池c电极变蓝,故C错误;
D、乙池中为惰性电极电解氯化钠溶液,电解产物为氯气、氢气、氢氧化钠,所以电解后pH增大,故D错误;
故选B.
B、C2H5OH在碱性条件下放电生成碳酸盐,方程式为:C2H5OH+16OH--12e-═2CO32-+11H2O,故B正确;
C、乙池为电解池,d为阴极,氢离子得电子,c为阳极,氯离子失电子,则在c极附近生成氯气,故用湿润淀粉KI试纸靠近乙池c电极变蓝,故C错误;
D、乙池中为惰性电极电解氯化钠溶液,电解产物为氯气、氢气、氢氧化钠,所以电解后pH增大,故D错误;
故选B.
点评:本题考查了原电池、电解池原理、热化学反应方程式的书写,明确燃料电池正负极的判断方法、电解池离子放电顺序即可解答,难点是电极反应式的书写,难度中等.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、0.1 mol?L-1醋酸溶液中离子总数为0.2NA |
| B、T℃时,pH=6的纯水中,含10-8NA个OH- |
| C、25℃时,1L pH=13的氢氧化钠溶液中含有0.1NA氢氧根离子 |
| D、1L 0.1 mol?L-1的硫化钠溶液中硫离子数目为0.1NA |
除去KNO3溶液中的少量Ca(NO3)2杂质,可以使用的方法为( )
| A、加入过量的Na2CO3溶液,过滤除去沉淀,所得溶液中补加适量稀HNO3 |
| B、加入过量的KCl溶液,过滤除去沉淀,所得溶液中补加适量稀HNO3 |
| C、加入过量的K2CO3溶液,过滤除去沉淀,所得溶液中补加适量稀HNO3 |
| D、加入过量的NaCl溶液,过滤除去沉淀,所得溶液中补加适量稀HNO3 |
需加入适当的氧化剂才能实现的反应是( )
| A、PCl5→PCl3 |
| B、MnO2→Mn2+ |
| C、SO2→SO32- |
| D、Fe→Fe2O3 |
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A、200mL 1mol/L的NaCl溶液中阴阳离子总数为0.2NA |
| B、标准状况下,11.2L乙醇中的分子数为0.5NA |
| C、58.5gNaCl完全溶于2L水中,得到NaCl溶液的物质的量浓度为0.5mol/L |
| D、1mol金属Na与足量的O2反应生成Na2O和Na2O2混合物,Na失去的电子数为NA |
 根据信息回答列问题:
根据信息回答列问题: