题目内容
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O发生反应:CO(g)+H2O(g)?CO2+H2(g),反应在t2时达到平衡,
下列说法不正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.40 | |
| t2 | 0.80 |
| A、反应在t1min内的平均速率为v(H2)=(0.10/t1 )mol?L-1?min-1 |
| B、保持其他条件不变,向平衡体系中再通入0.60 molCO和1.20 molH2O,到达平衡时,c(CO2)=0.90 mol?L-1 |
| C、保持其他条件不变,向平衡体系中再通入0.20 mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大 |
| D、温度升至850℃,上述反应的平衡常数变为0.85,则该反应的正反应为放热反应 |
考点:化学平衡的计算
专题:
分析:A.根据v=
计算v(H2O),结合化学反应速率之比等于化学计量数之比计算v(H2);
B.再充入0.60 mol CO和1.20 mol H2O,则相当于共充入1.80 mol CO和1.80mol H2O到达平衡时,根据K不变列式计算;
C.保持其他条件不变,增加一种反应物的浓度,平衡向正反应方向移动,另一种反应物的转化率增大;
D.根据平衡时各物质的浓度计算700℃时的平衡常数,比较不同温度下的平衡常数大小可判断反应的吸放热.
| △c |
| △t |
B.再充入0.60 mol CO和1.20 mol H2O,则相当于共充入1.80 mol CO和1.80mol H2O到达平衡时,根据K不变列式计算;
C.保持其他条件不变,增加一种反应物的浓度,平衡向正反应方向移动,另一种反应物的转化率增大;
D.根据平衡时各物质的浓度计算700℃时的平衡常数,比较不同温度下的平衡常数大小可判断反应的吸放热.
解答:
解:A.v(H2O)=
=
mol/(L?min),化学反应速率之比等于化学计量数之比,则v(H2)=v(H2O)=
mol/(L?min),故A正确;
B.由t2min时反应已经达到平衡状态,此时c(CO)=
=0.4mol/L,c(H2O)=
=0.1mol/L,c(CO2)=c(H2)=
=0.2mol/L,则k=
=1,当再充入0.60 mol CO和1.20 mol H2O,则相当于共充入1.80 mol CO和1.80mol H2O到达平衡时,则
CO(g)+H2O(g)?CO2+H2(g),
开始(mol) 1.8 1.8 0 0
转化(mol) x x x x
平衡(mol) 1.8-x 1.8-x x x
根据K=1=
,解得x=0.9mol,所以c(CO2)=
=0.45 mol?L-1,故B错误;
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,故C正确;
D.t2min时反应已经达到平衡状态,此时c(CO)=
=0.4mol/L,c(H2O)=
=0.1mol/L,c(CO2)=c(H2)=
=0.2mol/L,则k=
=1,温度升至850℃,上述反应平衡常数为0.85,说明温度升高,平衡是向左移动的,那么正反应应为放热反应,故D正确;
故选B.
| ||
| t1min |
| 0.1 |
| t 1 |
| 0.1 |
| t 1 |
B.由t2min时反应已经达到平衡状态,此时c(CO)=
| 0.8mol |
| 2L |
| 0.2mol |
| 2L |
| 0.4mol |
| 2L |
| 0.2×0.2 |
| 0.4×0.1 |
CO(g)+H2O(g)?CO2+H2(g),
开始(mol) 1.8 1.8 0 0
转化(mol) x x x x
平衡(mol) 1.8-x 1.8-x x x
根据K=1=
| x 2 |
| (1.8-x)2 |
| 0.9mol |
| 2L |
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,故C正确;
D.t2min时反应已经达到平衡状态,此时c(CO)=
| 0.8mol |
| 2L |
| 0.2mol |
| 2L |
| 0.4mol |
| 2L |
| 0.2×0.2 |
| 0.4×0.1 |
故选B.
点评:本题属于化学平衡问题,主要考查学生对速率概念与计算,平衡常数概念与计算,平衡移动等有关内容理解和掌握程度,题目难度中等,注意C选项中的规律利用.

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
为了防止FeSO4被氧化而变质,实验室在配制FeSO4溶液时,常在溶液中加入少量的( )
| A、铜粉 |
| B、铁粉 |
| C、锌粉 |
| D、Fe3(SO4)3 |
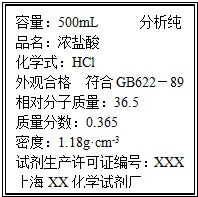 取质量为13.7g的Na2CO3和NaHCO3的固体混合物,与100mL 2.00mol?L-1的盐酸恰好完全反应不再放出气体.
取质量为13.7g的Na2CO3和NaHCO3的固体混合物,与100mL 2.00mol?L-1的盐酸恰好完全反应不再放出气体.