题目内容
A、B、C、D、E是中学化学中五种常见元素,有关信息如下:
请回答下列问题:
(1)A的氢化物分子的电子式是 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式: .
(2)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为 .
(3)A、D的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法及现象是: ,证明存在该阳离子.
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: .
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏.
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)A的氢化物分子的电子式是
(2)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为
(3)A、D的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法及现象是:
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏.
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A最高价氧化物对应的水化物与其氢化物反应生成离子化合物,应为N元素,B为地壳中含量最多的元素,应为O元素,C单质须保存在煤油中,应为Na,D单质与NaOH溶液反应可用于生产漂白液,应为Cl元素,E单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏,应为Fe,据此答题.
解答:
解:A最高价氧化物对应的水化物与其氢化物反应生成离子化合物,应为N元素,B为地壳中含量最多的元素,应为O元素,C单质须保存在煤油中,应为Na,D单质与NaOH溶液反应可用于生产漂白液,应为Cl元素,E单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏,应为Fe,
(1)A的氢化物为NH3,电子式为 ,其最高价氧化物对应的水化物硝酸与氨气反应的离子方程式为:NH3+H+=NH4+,
,其最高价氧化物对应的水化物硝酸与氨气反应的离子方程式为:NH3+H+=NH4+,
故答案为: ; NH3+H+=NH4+;
; NH3+H+=NH4+;
(2)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,该化合物为Na2O2,含有离子键和共价键,
故答案为:离子键和共价键;
(3)A、D的氢化物分别为 NH3、HCl,相互反应,产生白色固体,对该固体中阳离子为NH4+,可与碱反应生成碱性气体NH3,用湿润的红色石蕊试纸接近试管口检验放出的气体,试纸变蓝,与浓盐酸反应生成白烟,
故答案为:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生);
(4)A与B可组成质量比为7:16的三原子分子,应为NO2,可导致酸雨和光化学烟雾,故答案为:①③.
(1)A的氢化物为NH3,电子式为
 ,其最高价氧化物对应的水化物硝酸与氨气反应的离子方程式为:NH3+H+=NH4+,
,其最高价氧化物对应的水化物硝酸与氨气反应的离子方程式为:NH3+H+=NH4+,故答案为:
 ; NH3+H+=NH4+;
; NH3+H+=NH4+;(2)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,该化合物为Na2O2,含有离子键和共价键,
故答案为:离子键和共价键;
(3)A、D的氢化物分别为 NH3、HCl,相互反应,产生白色固体,对该固体中阳离子为NH4+,可与碱反应生成碱性气体NH3,用湿润的红色石蕊试纸接近试管口检验放出的气体,试纸变蓝,与浓盐酸反应生成白烟,
故答案为:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生);
(4)A与B可组成质量比为7:16的三原子分子,应为NO2,可导致酸雨和光化学烟雾,故答案为:①③.
点评:本题考查无机物的推断,题目难度不大,注意根据物质的性质推断元素的种类,把握反应原理和应用.

练习册系列答案
相关题目
将钠、镁、铝各0.3mol,分别放入100mL 1mol?L-1的硫酸中,同温同压下产生的气体的体积比是( )
| A、1:2:3 |
| B、6:3:2 |
| C、3:2:2 |
| D、3:1:1 |
下列离子方程式中,表达正确的是( )
| A、等体积、等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合时发生反应:HCO3-+Ba2++OH-=BaCO3↓+H2O | ||||
| B、向AlCl3溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O | ||||
C、用铜作电极电解硫酸溶液:2H2O
| ||||
| D、硫酸亚铁溶液和稀硫酸、过氧化氢混合:Fe2++2H2O2+4H+=Fe3++4H2O |
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O发生反应:CO(g)+H2O(g)?CO2+H2(g),反应在t2时达到平衡,
下列说法不正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.40 | |
| t2 | 0.80 |
| A、反应在t1min内的平均速率为v(H2)=(0.10/t1 )mol?L-1?min-1 |
| B、保持其他条件不变,向平衡体系中再通入0.60 molCO和1.20 molH2O,到达平衡时,c(CO2)=0.90 mol?L-1 |
| C、保持其他条件不变,向平衡体系中再通入0.20 mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大 |
| D、温度升至850℃,上述反应的平衡常数变为0.85,则该反应的正反应为放热反应 |
A、B、C、D四种短周期元素原子序数依次增大,A原子为半径最小的原子,C原子最外层电子数与A、B原子最外层电子数之和相等,D原子和B原子最外层电子数的和为C原子最外层电子数的2倍,D原子的最外层电子数为电子层数的3倍.下列说法正确的是( )
| A、原子半径大小顺序为:B>C>D>A |
| B、四种元素都属于非金属元素,它们之间只能形成共价化合物 |
| C、B、C元素位于元素周期表中第二周期,D元素位于元素周期表中第三周期 |
| D、BA4、CA4+两种微粒都具有正四面体结构,B、C、D三种元素都有属于分子晶体、原子晶体的同素异形体 |
短周期元素X、Y、Z、R、W五种元素原子序数依次增大,其中X与Z、Y与W分别为同族元素,原子半径X<Y<W<R<Z,W原子的最外层电子数比内层电子总数少4,Z、R的核外电子数之和与Y、W核外电子数之和相等.下列说法不正确的是( )
| A、工业上用电解法获得Z、R的单质 |
| B、Y、Z、R的简单离子具有相同的电子层结构 |
| C、由X与Y、X与W形成的化合物放在空气中都易变质 |
| D、由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生复分解反应 |
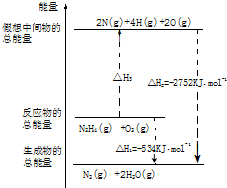 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用. ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空: