��Ŀ����
 ȡ����Ϊ13.7g��Na2CO3��NaHCO3�Ĺ��������100mL 2.00mol?L-1������ǡ����ȫ��Ӧ���ٷų����壮
ȡ����Ϊ13.7g��Na2CO3��NaHCO3�Ĺ��������100mL 2.00mol?L-1������ǡ����ȫ��Ӧ���ٷų����壮��1����ԭ�������Na2CO3����������Ϊ
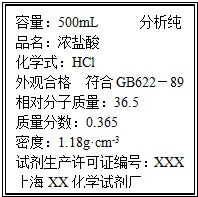
��2����100mL 2.00mol?L-1���������ñ�ǩ��ͼ��ʾ��Ũ�����Ƶã������Ũ��������Ϊ
��3����ȡ��������ԭ����������Һ����ε���75mL 2.00mol?L-1�����ᣬ�����Ͻ��裬�����ɵ������ڱ�״���µ������
���㣺�йػ���ﷴӦ�ļ���,��ѧ����ʽ���йؼ���
ר�⣺
��������1�����̼���ơ�̼�����Ƶ����ʵ��������ݻ�������������������Ȼ�������ʵ��������̼���ơ�̼�����Ƶ����ʵ������ټ�����������̼���Ƶ�����������
��2���ȸ���c=
�����Ũ��������ʵ���Ũ�ȣ�Ȼ�������Һϡ���������ʵ����ʵ�������������ҪŨ����������
��3��100mL 2.00mol?L-1������ǡ����ȫ��Ӧ��75mL����㣬̼�����Ȳ��뷴Ӧ����̼�����ƣ������Ȼ�������ʵ�����̼����ת����̼���������ĵ����ʵ����������̼�����Ʒ�Ӧ���Ȼ�������ʵ������ٸ��ݷ�Ӧ��������ɵĶ�����̼�������
��2���ȸ���c=
| 1000��w |
| M |
��3��100mL 2.00mol?L-1������ǡ����ȫ��Ӧ��75mL����㣬̼�����Ȳ��뷴Ӧ����̼�����ƣ������Ȼ�������ʵ�����̼����ת����̼���������ĵ����ʵ����������̼�����Ʒ�Ӧ���Ȼ�������ʵ������ٸ��ݷ�Ӧ��������ɵĶ�����̼�������
���
�⣺��1����������Na2CO3��NaHCO3�����ʵ����ֱ�Ϊx��y��
NaHCO3+HCl�TNaCl+CO2��+H2O
1 1
y y
Na2CO3+2HCl�T2NaCl+CO2��+H2O
1 2
x 2x
��106x+84y=13.7g
2x+y=0.1L��2.0mol?L-1=0.20mol��
��ã�x=0.05mol��y=0.1mol��
�أ�Na2CO3��=
��100%��38.7%��
�ʴ�Ϊ��38.7%��
��2����Ũ��������ʵ���Ũ��Ϊ��c��HCl��=
mol/L=11.8mol/L��
��Һ��ϡ���������ʵ����ʵ������䣬����ҪŨ��������Ϊ��V[HCl��aq��]=
��0.017L=17mL��
�ʴ�Ϊ��17mL��
��3������ǡ����ȫ��Ӧ��100mL 2.50mol?L-1�����ᣬ�ʼ�75mLʱ������㣬̼�����ȷ�Ӧ����̼�����ƣ�Ȼ��̼�����������ᷴӦ���ɶ�����̼��
75mL 2.00mol?L-1�������к����Ȼ�������ʵ���Ϊ��2.00mol/L��0.075L=0.15mol��
Na2CO3 +HCl=NaHCO3+NaCl ��
1 1
0.05mol 0.05mol��
����̼�����Ʒ�Ӧ��HCl�����ʵ���Ϊ��0.15mol-0.05mol=0.1mol��
NaHCO3 +HCl=NaCl+H2O+CO2��
1mol 22.4L
0.1mol V
��V��CO2��=
=2.24L��
�����ɵ������ڱ�״���µ����Ϊ2.24L��
NaHCO3+HCl�TNaCl+CO2��+H2O
1 1
y y
Na2CO3+2HCl�T2NaCl+CO2��+H2O
1 2
x 2x
��106x+84y=13.7g
2x+y=0.1L��2.0mol?L-1=0.20mol��
��ã�x=0.05mol��y=0.1mol��
�أ�Na2CO3��=
| 106g/mol��0.05mol |
| 13.7g |
�ʴ�Ϊ��38.7%��
��2����Ũ��������ʵ���Ũ��Ϊ��c��HCl��=
| 1000��1.18��36.6 |
| 36.5 |
��Һ��ϡ���������ʵ����ʵ������䣬����ҪŨ��������Ϊ��V[HCl��aq��]=
| 2.00mol/L��0.1L |
| 11.8mol/L |
�ʴ�Ϊ��17mL��
��3������ǡ����ȫ��Ӧ��100mL 2.50mol?L-1�����ᣬ�ʼ�75mLʱ������㣬̼�����ȷ�Ӧ����̼�����ƣ�Ȼ��̼�����������ᷴӦ���ɶ�����̼��
75mL 2.00mol?L-1�������к����Ȼ�������ʵ���Ϊ��2.00mol/L��0.075L=0.15mol��
Na2CO3 +HCl=NaHCO3+NaCl ��
1 1
0.05mol 0.05mol��
����̼�����Ʒ�Ӧ��HCl�����ʵ���Ϊ��0.15mol-0.05mol=0.1mol��
NaHCO3 +HCl=NaCl+H2O+CO2��
1mol 22.4L
0.1mol V
��V��CO2��=
| 22.4L��0.1mol |
| 1mol |
�����ɵ������ڱ�״���µ����Ϊ2.24L��
���������⿼�����йػ����ļ��㣬��Ŀ�Ѷ��еȣ���ȷ̼���ơ�̼���������Ȼ��ⷴӦ�ķ���ʽ�ǽ���ؼ���ע�������йػ����ļ��㷽�����ܹ�������Һ���ܶȡ�����������������ʵ����ʵ���Ũ�ȣ�

��ϰ��ϵ�д�
�����Ŀ
���淴ӦN2��g��+3H2��g ��?2NH3��g������500��ʱ����2mol N2��2mol H2�����ݻ�Ϊ10L���ܱ������н��з�Ӧ���ﵽƽ��ʱ��NH3�����ܴﵽ��Ũ���ǣ�������
| A��0.08mol?L-1 |
| B��0.12 mol?L-1 |
| C��0.05 mol?L-1 |
| D��0.14mol?L-1 |
�������ӷ���ʽ�У�������ȷ���ǣ�������
| A��������������ʵ���Ũ�ȵ�NaHCO3��Һ��Ba��OH��2��Һ���ʱ������Ӧ��HCO3-+Ba2++OH-=BaCO3��+H2O | ||||
| B����AlCl3��Һ�м��������ˮ��Al3++4NH3?H2O=AlO2-+4NH4++2H2O | ||||
C����ͭ���缫���������Һ��2H2O
| ||||
| D������������Һ��ϡ���ᡢ���������ϣ�Fe2++2H2O2+4H+=Fe3++4H2O |
700��ʱ�����ݻ�Ϊ2L���ܱ������г���һ������CO��H2O������Ӧ��CO��g��+H2O��g��?CO2+H2��g������Ӧ��t2ʱ�ﵽƽ�⣬
����˵������ȷ���ǣ�������
| ��Ӧʱ��/min | n��CO��/mol | n��H2O��/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.40 | |
| t2 | 0.80 |
| A����Ӧ��t1min�ڵ�ƽ������Ϊv��H2��=��0.10/t1 ��mol?L-1?min-1 |
| B�����������������䣬��ƽ����ϵ����ͨ��0.60 molCO��1.20 molH2O������ƽ��ʱ��c��CO2��=0.90 mol?L-1 |
| C�����������������䣬��ƽ����ϵ����ͨ��0.20 mol H2O��g������ԭƽ����ȣ��ﵽ��ƽ��ʱCOת�������� |
| D���¶�����850�棬������Ӧ��ƽ�ⳣ����Ϊ0.85����÷�Ӧ������ӦΪ���ȷ�Ӧ |
A��B��C��D���ֶ�����Ԫ��ԭ��������������Aԭ��Ϊ�뾶��С��ԭ�ӣ�Cԭ��������������A��Bԭ������������֮����ȣ�Dԭ�Ӻ�Bԭ�������������ĺ�ΪCԭ��������������2����Dԭ�ӵ�����������Ϊ���Ӳ�����3��������˵����ȷ���ǣ�������
| A��ԭ�Ӱ뾶��С˳��Ϊ��B��C��D��A |
| B������Ԫ�ض����ڷǽ���Ԫ�أ�����֮��ֻ���γɹ��ۻ����� |
| C��B��CԪ��λ��Ԫ�����ڱ��еڶ����ڣ�DԪ��λ��Ԫ�����ڱ��е������� |
| D��BA4��CA4+��������������������ṹ��B��C��D����Ԫ�ض������ڷ��Ӿ��塢ԭ�Ӿ����ͬ�������� |
���ڷ�Ӧ2A��g��+B��g��?2C��g����H��0������ͼ����ȷ���ǣ�������


| A���٢� | B���ڢ� | C���٢� | D���ڢ� |
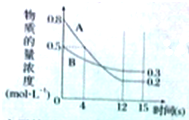 ��֪����ӦaA��g��+bB��g��?cC��g��ij�¶��£���2L���ܱ�������Ͷ��һ������A��B��������������ʵ���Ũ����ʱ��仯��������ͼ��ʾ��
��֪����ӦaA��g��+bB��g��?cC��g��ij�¶��£���2L���ܱ�������Ͷ��һ������A��B��������������ʵ���Ũ����ʱ��仯��������ͼ��ʾ��