题目内容
下列判断正确的是( )
| A、原子形成具有相同电子层结构的离子后,原子序数小的离子半径一定大 |
| B、同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
| C、氯化氢的沸点比氟化氢的沸点高 |
| D、从HF、HCI、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增的规律 |
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A.具有相同电子层结构的离子,原子序数越小,半径越大;
B.同主族元素化学性质具有相似性与递变性,化学性质不完全相同;
C.氟化氢含有氢键,沸点较高;
D.根据元最高价氧化物对应水化物的酸的酸性来比较非金属元素的得电子能力;
B.同主族元素化学性质具有相似性与递变性,化学性质不完全相同;
C.氟化氢含有氢键,沸点较高;
D.根据元最高价氧化物对应水化物的酸的酸性来比较非金属元素的得电子能力;
解答:
解:A.原子形成具有相同电子层结构的离子后,原子序数越小,半径越大,故A正确;
B.同一主族的元素的原子,最外层电子数相同,自上而下原子半径增大,化学性质不完全相同,如ⅠA族中H元素与碱金属元素性质相差很大,故B错误;
C.氟化氢分子中存在氢键,沸点较高,所以氯化氢的沸点比氟化氢的沸点低,故C错误;
D.元最高价氧化物对应水化物的酸的酸性越强,则非金属元素的得电子能力越强,不能根据元素氢化物的酸性来比较,故D错误;
故选A.
B.同一主族的元素的原子,最外层电子数相同,自上而下原子半径增大,化学性质不完全相同,如ⅠA族中H元素与碱金属元素性质相差很大,故B错误;
C.氟化氢分子中存在氢键,沸点较高,所以氯化氢的沸点比氟化氢的沸点低,故C错误;
D.元最高价氧化物对应水化物的酸的酸性越强,则非金属元素的得电子能力越强,不能根据元素氢化物的酸性来比较,故D错误;
故选A.
点评:本题侧重于元素周期律知识的考查,注意元最高价氧化物对应水化物的酸的酸性越强,则非金属元素的得电子能力越强这一规律,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
A、MnO2 与浓盐酸反应制Cl2:MnO2+4HCl
| ||||
| B、明矾溶于水产生Al(OH)3 胶体:Al3++3H2O═Al(OH)3↓+3H+ | ||||
| C、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | ||||
| D、Na2O2 溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ |
下列说法中正确的是( )
| A、常温下,反应4Fe(OH)2(s)+2H2O(1)+O2(g)=4Fe(OH)3(s)能自发进行,则该反应的△H<0 |
| B、浑浊的苯酚试液中加入饱和Na2CO3溶液变澄清,则酸性:苯酚>碳酸 |
| C、铅蓄电池在放电过程中,负极质量减少,正极质量增加 |
| D、用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3,说明Ksp(BaSO4)>Ksp(BaCO3) |
铜易生锈,铜合金更易生锈,铜器上往往覆盖着一层铜绿,铜绿的主要成分是( )
| A、CuO |
| B、Cu(OH)2 |
| C、Cu2O |
| D、Cu2(OH)2CO3 |


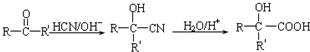
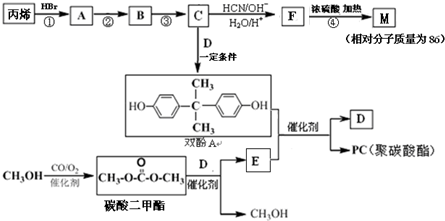
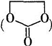 能与CH3OH发生酯交换反应生成碳酸二甲酯和另一种醇,写出该反应的化学方程式
能与CH3OH发生酯交换反应生成碳酸二甲酯和另一种醇,写出该反应的化学方程式