题目内容
下列说法中正确的是( )
| A、常温下,反应4Fe(OH)2(s)+2H2O(1)+O2(g)=4Fe(OH)3(s)能自发进行,则该反应的△H<0 |
| B、浑浊的苯酚试液中加入饱和Na2CO3溶液变澄清,则酸性:苯酚>碳酸 |
| C、铅蓄电池在放电过程中,负极质量减少,正极质量增加 |
| D、用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3,说明Ksp(BaSO4)>Ksp(BaCO3) |
考点:难溶电解质的溶解平衡及沉淀转化的本质,原电池和电解池的工作原理,焓变和熵变,比较弱酸的相对强弱的实验
专题:
分析:A、依据自发进行的是反应判断依据是△H-T△S<0;结合反应是熵变减小的反应结合判断依据分析焓变;
B、苯酚和碳酸钠溶液反应生成碳酸氢钠和苯酚钠;
C、铅蓄电池放电时两极均生成硫酸铅;
D、沉淀形成与离子浓度大小有关,当Qc=c(Ba2+)×c(CO32-)>Ksp(BaCO3)会生成沉淀.
B、苯酚和碳酸钠溶液反应生成碳酸氢钠和苯酚钠;
C、铅蓄电池放电时两极均生成硫酸铅;
D、沉淀形成与离子浓度大小有关,当Qc=c(Ba2+)×c(CO32-)>Ksp(BaCO3)会生成沉淀.
解答:
解:A、常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)能自发进行,证明△H-T△S<0;反应物有气体生成物没有气体,则△S<0,所以满足自发进行,△H必须小于0,故A正确;
B、苯酚和碳酸钠溶液反应生成碳酸氢钠和苯酚钠,说明苯酚酸性强于碳酸氢根离子,不能证明苯酚酸性比碳酸强;故B错误;
C、铅蓄电池工作时,负极是金属铅失电子生成硫酸铅沉淀质量增大,正极上是二氧化铅得电子,生成硫酸铅沉淀质量增加;故C错误;
D、BaSO4沉淀中加入饱和Na2CO3溶液可将BaSO4转化为BaCO3,是因为碳酸根离子浓度大,碳酸根离子浓度和钡离子浓度乘积大于碳酸钡的Ksp,形成过饱和溶液,会析出BaCO3沉淀,而实际上Ksp(BaSO4)小于Ksp(BaCO3),故D错误;
故选A.
B、苯酚和碳酸钠溶液反应生成碳酸氢钠和苯酚钠,说明苯酚酸性强于碳酸氢根离子,不能证明苯酚酸性比碳酸强;故B错误;
C、铅蓄电池工作时,负极是金属铅失电子生成硫酸铅沉淀质量增大,正极上是二氧化铅得电子,生成硫酸铅沉淀质量增加;故C错误;
D、BaSO4沉淀中加入饱和Na2CO3溶液可将BaSO4转化为BaCO3,是因为碳酸根离子浓度大,碳酸根离子浓度和钡离子浓度乘积大于碳酸钡的Ksp,形成过饱和溶液,会析出BaCO3沉淀,而实际上Ksp(BaSO4)小于Ksp(BaCO3),故D错误;
故选A.
点评:本题考查了反应自发进行的判断依据、物质酸性比较、铅蓄电池、沉淀的转化等,侧重于基础知识的应用的考查,题目难度中等,注意铅蓄电池中两极上均生成硫酸铅沉淀,电极质量增大.

练习册系列答案
相关题目
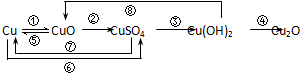
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
| 物质 编号 | 物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| ① |  | Cu | CuO | CuSO4 | Cu(NO3)2 |
| ② | Na2CO3 | NaOH | NaHCO3 | CO2 | |
| ③ | (NH4)2SO3 | CaSO3 | SO2 | NH4HSO3 | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(NO3)2 |
| A、①②③④ | B、①②③ |
| C、①③④ | D、②④ |
将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻,铜片质量减小的是( )
| A、硝酸 | B、无水乙醇 |
| C、石灰水 | D、盐酸 |
下列判断正确的是( )
| A、原子形成具有相同电子层结构的离子后,原子序数小的离子半径一定大 |
| B、同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
| C、氯化氢的沸点比氟化氢的沸点高 |
| D、从HF、HCI、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增的规律 |
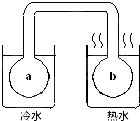 如图所示,密封双球体系中充有红棕色气体X.将左右烧杯中水浴造成温差后,发现a中气体颜色比b中气体的颜色深(不考虑气体液化),则X可能是( )
如图所示,密封双球体系中充有红棕色气体X.将左右烧杯中水浴造成温差后,发现a中气体颜色比b中气体的颜色深(不考虑气体液化),则X可能是( )| A、NO2(g) |
| B、Br2(g) |
| C、NO(g) |
| D、N2(g) |
某粒子含有6个电子、7个中子,呈电中性,则它的化学符号可能是( )
| A、13Al |
| B、13Al |
| C、13C |
| D、13C |