题目内容
3.下列有关实验操作的叙述错误的是( )| A. | 过滤操作中,玻璃棒应适时搅拌漏斗器 | |
| B. | 蒸发时,不能把蒸发皿放置于石棉网上加热 | |
| C. | 萃取分液时,将塞上凹槽或小孔对准漏斗上小孔,然后打开活塞才能放出下层液体 | |
| D. | 配制容量瓶,定容时改用胶头滴管滴加蒸馏水 |
分析 A.过滤时注意防止滤渣破损;
B.蒸发皿可直接加热;
C.萃取分液时,应使分液漏斗内外压强相等;
D.定容时应注意蒸馏水不能超过刻度线.
解答 解:A.过滤时,不能用玻璃棒搅拌,防止滤渣破损,故A错误;
B.蒸发皿可直接加热,不能把蒸发皿放置于石棉网上加热,故B正确;
C.萃取分液时,应使分液漏斗内外压强相等,可将塞上凹槽或小孔对准漏斗上小孔,然后打开活塞才能放出下层液体,故C正确;
D.定容时应注意蒸馏水不能超过刻度线,可用胶头滴管滴加蒸馏水,故D正确.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯实验、实验技能为解答的关键,侧重分析与实验能力的考查,注意物质的分离的仪器及原理,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.298K时,合成氨反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol,在该温度下,取1mol N2和3mol H2放在密闭容器内反应.下列说法正确的是( )
| A. | 在有催化剂存在的条件下,反应放出的热量为92.4 kJ | |
| B. | 有无催化剂该反应放出的热量都为92.4 kJ | |
| C. | 若再充入1 mol H2,到达平衡时放出的热量应为92.4 kJ | |
| D. | 反应放出的热量始终小于92.4 kJ |
11.用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一.
(1)Fe还原水体中NO3-的反应原理如图1所示.

②作负极的物质是铁.
②正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如表:
pH=4.5时,NO3-的去除率低.其原因是FeO(OH)不导电,阻碍电子转移.
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如右图2所示,可得到的结论是本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4.结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移.pH=4.5(其他条件相同)
(1)Fe还原水体中NO3-的反应原理如图1所示.

②作负极的物质是铁.
②正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如表:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 |  |  |
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如右图2所示,可得到的结论是本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4.结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移.pH=4.5(其他条件相同)
18.KMnO4与H2C2O4反应,生成Mn2+和CO2,酸性条件下,用0.100mol•L-1KMnO4标准溶液滴定20.00mLH2C2O4溶液,达到滴定终点时,消耗16.00mL标准溶液,则H2C2O4溶液的浓度为( )
| A. | 0.400mol•L-1 | B. | 0.300mol•L-1 | C. | 0.200mol•L-1 | D. | 0.100mol•L-1 |
8.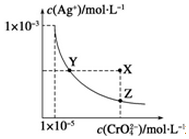 在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgBr的Ksp=5.0×10-13,下列说法错误的是( )
在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgBr的Ksp=5.0×10-13,下列说法错误的是( )
 在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgBr的Ksp=5.0×10-13,下列说法错误的是( )
在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgBr的Ksp=5.0×10-13,下列说法错误的是( )| A. | t℃时,Ag2CrO4的Ksp为1×10-8 | |
| B. | 在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 | |
| C. | 一定温度下Y点和Z点时Ag2CrO4的Ksp相等 | |
| D. | 在t℃时,Ag2CrO4(s)+2Br-(aq)?2AgBr(s)+CrO42-(aq)平衡常数K=4.0×1010 |
12.下列有关化学用语表示正确的是( )
| A. | NH3的电子式: | |
| B. | CS2分子的球棍模型: | |
| C. | 二氧化硅的分子式:SiO2 | |
| D. | Mg5(Si4O10)2(OH)2•4H2O的氧化物形式:5MgO•8SiO2•5H2O |
13.工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但钾却不能用电解熔融KCl的方法制得,因金属钾易溶于熔融态的KCl中而有危险,难获得钾,且降低电流效率.现生产钾是用属钠和熔化的KCl在一定的条件下反应制取:
KCl+Na $\stackrel{一定条件}{?}$ NaCl+K+Q (Q<0)
有关数据如下表:
(1)工业上制取金属钾的化学原理是化学平衡移动原理(勒夏特列原理/钾蒸汽逸出使生成物浓度减小,平衡向正反应方向移动,可不断得到金属钾),在常压下金属钾转为气态从反应混合物中分离的最低温度约为774℃,而反应的最高温度应低于882.9℃.
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是适当的降低温度或移去钾蒸气.
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,且将该气体可循环利用,该气体是d.
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K=$\frac{c(K)}{c(Na)}$.
KCl+Na $\stackrel{一定条件}{?}$ NaCl+K+Q (Q<0)
有关数据如下表:
| 熔点℃ | 沸点℃ | 密度(g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500(升华) | 1.984 |
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是适当的降低温度或移去钾蒸气.
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,且将该气体可循环利用,该气体是d.
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K=$\frac{c(K)}{c(Na)}$.


 ;
; ;
;
 .
.