题目内容
10.已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如图1所示.
乙酸乙酯的实验室和工业制法常采用如图2装置:回答下列问题:
(1)写出A的电子式
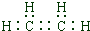 .
.(2)B、D分子中的官能团名称分别羟基、羧基.
(3)写出下列反应的反应类型:①加成反应②氧化反应,④酯化反应或取代反应.
(4)写出下列反应的化学方程式:①CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH ②2 CH3CH2OH+O2$→_{△}^{Cu}$2 CH3CHO+2H2O ④CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O
(5)制取乙酸乙酯浓H2SO4的作用是:①吸水剂,②催化剂.欲提高乙酸的转化率,可采取的措施有增大乙醇的浓度、移去生成物等.
(6)碳酸钠溶液的作用是吸收乙醇、中和乙酸、降低乙酸乙酯溶解度,导气管不能插入液面以下,原因是防倒吸.加热前,大试管中加入几粒碎瓷片的作用是防暴沸.
(7)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是CH2BrCH2Br.
分析 A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,与水发生加成反应得到B为CH3CH2OH,B能氧化得到C为CH3CHO,C氧化得到D为CH3COOH,乙醇与乙酸发生酯化反应得到CH3COOC2H5,结合题目分析解答.
解答 解:A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,与水发生加成反应得到B为CH3CH2OH,B能氧化得到C为CH3CHO,C氧化得到D为CH3COOH,乙醇与乙酸发生酯化反应得到CH3COOC2H5,
(1)由上述分析可知,A的结构简式为CH2=CH2,电子式为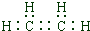 ,故答案为:
,故答案为: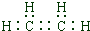 ;
;
(2)B为为CH3CH2OH,含有官能团为羟基,D为CH3COOH,官能团名称是羧基,故答案为:羟基;羧基;
(3)通过以上分析知,①②④分别是加成反应、氧化反应、酯化反应或取代反应,
故答案为:加成反应;氧化反应;酯化反应或取代反应;
(4)反应①的化学方程式为:CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH;
反应②的化学方程式为:2 CH3CH2OH+O2$→_{△}^{Cu}$2 CH3CHO+2H2O;
反应④的化学方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH;
2 CH3CH2OH+O2$→_{△}^{Cu}$2 CH3CHO+2H2O;
CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
(5)乙酸乙酯制取中浓硫酸能吸收生成的水,同时加快化学反应速率而作催化剂,欲提高乙酸的转化率,可以增大乙醇浓度、移去生成物,
故答案为:吸水剂;催化剂;增大乙醇的浓度;移去生成物;
(6)碳酸钠能吸收乙醇、中和乙酸、降低乙酸乙酯的溶解度,如果将导气管伸入液面下易产生倒吸,所以不能伸入液面下,碎瓷片有防暴沸作用,
故答案为:吸收乙醇;中和乙酸;降低乙酸乙酯溶解度;防倒吸;防暴沸;
(7)乙烯和溴发生加成反应生成CH2BrCH2Br,故答案为:CH2BrCH2Br.
点评 本题考查有机物推断、乙酸乙酯制取等知识点,为高频考点,侧重考查学生推断、实验操作能力,明确有机物官能团及其性质关系、化学反应原理等知识点是解本题关键,注意饱和碳酸钠溶液用途,题目难度不大.

| A. | b>c>a | B. | b>a>c | C. | c>b>a | D. | a>b>c |
(1)对PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式C(s)+H2O(g)=CO(g)+H2(g)H=+131.3KJ/mol;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是ab;
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是因为该反应为吸热反应,温度越高,反应速率加快,平衡右移.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的△H>0,简述该设想能否实现的依据该反应是焓增,熵减的反应,任何温度下均不自发进行.
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
(一)制备苯乙烯(原理如反应I所示):
I.
 △H=+124kJ•mol-1
△H=+124kJ•mol-1(1)部分化学键的键能如表所示:
| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | x | 436 |
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气.用化学平衡理论解释通入水蒸气的原因为正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率.
(3)从体系自由能变化的角度分析,反应I在高温(填“高温”或“低温”)下有利于其自发进行.
(二)制备α-氯乙基苯(原理如反应II所示):
II.
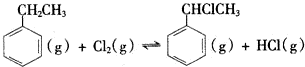 △H2>0
△H2>0(4)T℃时,向10L恒容密闭容器中充人2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,5min时达到平衡,乙苯和Cl2的物质的量浓度(c)随时间(t)变化的曲线如图l所示:

①0-5min内,以HC1表示的该反应速率v(HCl)=0.032 mol•L-1•min-1.
②T℃时,该反应的平衡常数K=16.
③6min时,改变的外界条件为升高温度.
④10min时,保持其他条件不变,再向容器中充人1moI乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,12min时达到新平衡.在图2中画出10-12 min,Cl2和HCl的浓度变化曲线(曲线上标明Cl2和HCl);0-5min和0-12min时间段,Cl2的转化率分别用α1、α2 表示,则αl<α2(填“>”、“<”或“=”).
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2?2NH3 该可逆反应达到平衡的标志是BCE.
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间而变化
E.a mol N≡N键断裂的同时,有6a mol N-H键断裂
F.N2、H2、NH3的分子数之比为1:3:2
(2)某化学研究性学习小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如表:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
该温度下平衡常数K=2.37.
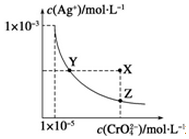 在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgBr的Ksp=5.0×10-13,下列说法错误的是( )
在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgBr的Ksp=5.0×10-13,下列说法错误的是( )| A. | t℃时,Ag2CrO4的Ksp为1×10-8 | |
| B. | 在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 | |
| C. | 一定温度下Y点和Z点时Ag2CrO4的Ksp相等 | |
| D. | 在t℃时,Ag2CrO4(s)+2Br-(aq)?2AgBr(s)+CrO42-(aq)平衡常数K=4.0×1010 |