��Ŀ����
2����ϩ��һ����Ҫ�Ļ�������ԭ�ϣ������ͼ1�ϳ�·�ߣ��ش��������⣮
��1����ϩ�Ľṹ��ʽ��CH2=CH2��A���Ҵ������������ŵ��������ǻ���
��2���Ʊ�F��CH3-CH2Cl�����������ַ�����
����һ �����������ȡ����Ӧ�������� ��ϩ���Ȼ���ļӳɷ�Ӧ�����������ڷ���һ��ԭ���ǣ�ԭ�������ʸߣ�����Ӧ������
��3������ϩΪԭ�Ϻϳ��л��߷��ӻ�����D������ϩ���Ļ�ѧ����ʽΪ��
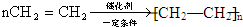 ��
����4������ϩΪԭ�Ͽ��Ժϳ�һ������ζ������E��ʵ���ҿ�ͨ����ͼ2��ʾװ����ʵ�֣���д�����±仯�Ļ�ѧ����ʽ��
��֪��Bת��ΪC�Ļ�ѧ����ʽΪ��2CH3CHO+O2$��_{��}^{����}$2CH3COOH
��A��B�Ļ�ѧ���̣�2CH3CH2OH+O2$��_{��}^{Cu}$2CH3CHO+2H2O��
��A+C��E�Ļ�ѧ����ʽ��CH3COOH+CH3CH2OH$?_{��}^{Ũ����}$CH3COOCH2CH3+H2O��
��5��װ���е���ĩ�˲��ܲ��뱥��̼������Һ�У���Ϊ�˷�ֹ̼������Һ������
��6���Թ��б���̼������Һ������Ϊ���кͻӷ������ᣬ�������������ֲ�����
��7������̼������Һ���Թ��пɿ�����ʵ������Ϊ��̼������Һ�������һ����ɫ��״����ζ��Һ�壮
���� ��ϩת���õ�A��A����������������Ӧ����C��A���ڴ���C�������ᣬ����ϩ��ˮ�����ӳɷ�Ӧ����AΪ�Ҵ���A����������Ӧ����BΪ��ȩ����ȩ��һ������������Ӧ����CΪ���ᣬ�������Ҵ�����������Ӧ����EΪ������������2����F���Ʊ�������֪��FΪ�����飬��3����DΪ�߷��ӻ��������������ʳƷ��װ��������ϩ�����Ӿ۷�Ӧ����DΪ����ϩ���Դ˽����⣮
��� �⣺��ϩת���õ�A��A����������������Ӧ����C��A���ڴ���C�������ᣬ����ϩ��ˮ�����ӳɷ�Ӧ����AΪ�Ҵ���A����������Ӧ����BΪ��ȩ����ȩ��һ������������Ӧ����CΪ���ᣬ�������Ҵ�����������Ӧ����EΪ������������2����F���Ʊ�������֪��FΪ�����飬��3����DΪ�߷��ӻ��������������ʳƷ��װ��������ϩ�����Ӿ۷�Ӧ����DΪ����ϩ��
��1����ϩ�Ľṹ��ʽΪCH2=CH2���Ҵ����еĹ�����Ϊ�ǻ����ʴ�Ϊ��CH2=CH2���ǻ���
��2���Ʊ������飬����һ�������������ȡ����Ӧ�����Կ��Ʒ���һ��ȡ��������Ӧ�࣬ԭ�������ʵͣ�����������ϩ���Ȼ���ļӳɷ�Ӧֻ���������飬ԭ�������ʸߣ�����Ӧ������
�ʴ�Ϊ��ԭ�������ʸߣ�����Ӧ������
��3����ϩ�����Ӿ۷�Ӧ���ɾ���ϩ����Ӧ����ʽΪ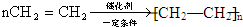 ���ʴ�Ϊ��
���ʴ�Ϊ��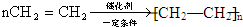 ��
��
��4������A��B���Ҵ�����������������������ѧ����ʽ�ǣ�2CH3CH2OH+O2$��_{��}^{Cu}$2CH3CHO+2H2O��
��A+C��E���Ҵ������ᷴӦ����������������ѧ����ʽ�ǣ�CH3COOH+CH3CH2OH$?_{��}^{Ũ����}$CH3COOCH2CH3+H2O��
�ʴ�Ϊ��2CH3CH2OH+O2$��_{��}^{Cu}$2CH3CHO+2H2O��CH3COOH+CH3CH2OH$?_{��}^{Ũ����}$CH3COOCH2CH3+H2O��
��5�����ɵ����������л������ᡢ�Ҵ���������ˮ�����ܽ����ܲ��뵽Һ�����£���ֹ̼������Һ�������ʴ�Ϊ����ֹ̼������Һ������
��6���������������ڱ���̼������Һ����������̼���Ʒ�Ӧ���Ҵ�������ˮ����̼������Һ���кͻӷ������ᣬ�������������ֲ����������ã�
�ʴ�Ϊ���кͻӷ������ᣬ�������������ֲ�������
��7���������������ڱ���̼������Һ���ɹ۲쵽̼������Һ�������һ����ɫ��״����ζ��Һ�壬
�ʴ�Ϊ��̼������Һ�������һ����ɫ��״����ζ��Һ�壮
���� ���⿼���л�����ƶϣ�Ϊ��Ƶ���㣬������ѧ���ķ�����ʵ�������Ŀ��飬��Ŀ�漰ϩ����±����������ȩ�������������ת�����Ƕ��л�������֪ʶ���ۺϿ��飬�ѶȲ���ע��Ի���֪ʶ���������գ�

�ٰ�A��B�õ������Ӻ�ͬʱ����ϡ�����У�A�������ݲ�����
�ڰ�C��D�õ������Ӻ�ͬʱ����ϡ�����У�D������ԭ��Ӧ��
�۰�A��C�õ������Ӻ�ͬʱ����ϡ�����У�������������ΪA�����ߡ�C��
�������ֽ����Ļ��˳��Ϊ��������
| A�� | A��B��C��D | B�� | C��A��B��D | C�� | D��B��C��A | D�� | B��A��C��D |
| A�� | ϡ�ͺ���Һ��pH=9 | |
| B�� | ϡ�����У���Һ���������ӵ�Ũ�Ⱦ���С | |
| C�� | ϡ�ͺ���Һ��$\frac{c��N{H}_{4}^{+}��}{c��N{H}_{3}��{H}_{2}O��}$��С | |
| D�� | �ð�ˮϡ��ǰ���к������������ͬ |
| A�� | CH4��C2H2��C3H4 | B�� | C2H6��C3H6��C4H6 | C�� | C2H6��C3H6��C3H4 | D�� | C2H4��C2H6��C3H6 |
| A�� |  ʵ�����Ʊ����ռ���ϩ | B�� |  ʯ�ͷ��� | ||
| C�� |  ʵ������������ | D�� |  ʵ�������������� |
| A�� | ������Ư�۾�����������ˮ��ɱ�������� | |
| B�� | �ö����ʵ����Խ�Al��OH��3�����NaCl��Һ���� | |
| C�� | CCl4��ȡ��ˮ�е�I2���ȴӷ�Һ©���¿ڷų��л��㣬��ӷ�Һ©���¿ڷų�ˮ�� | |
| D�� | Ũ������MnO2��Ӧ�Ʊ�����Cl2�����������ͨ��Ũ���ᣬ��ͨ������ʳ��ˮ |
| A�� | 1.17 | B�� | 0.74 | C�� | 0.293 | D�� | 1.03 |
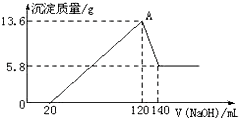 ��һ��������Mg-Al�Ͻ�Ͷ��100mLһ�����ʵ���Ũ�ȵ�ijHCl��Һ�У���ַ�Ӧ����Ӧ�����Һ����μ���һ�����ʵ���Ũ�ȵ�NaOH��Һ�����ɳ���������������NaOH��Һ�������ϵ��ͼ���ش��������⣺����Ҫ��д��������̣�
��һ��������Mg-Al�Ͻ�Ͷ��100mLһ�����ʵ���Ũ�ȵ�ijHCl��Һ�У���ַ�Ӧ����Ӧ�����Һ����μ���һ�����ʵ���Ũ�ȵ�NaOH��Һ�����ɳ���������������NaOH��Һ�������ϵ��ͼ���ش��������⣺����Ҫ��д��������̣�