题目内容
10.25℃,加水将10mL pH=11的氨水稀释至1L,则下列判断中正确的是( )| A. | 稀释后溶液的pH=9 | |
| B. | 稀释过程中,溶液中所有离子的浓度均减小 | |
| C. | 稀释后溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}.{H}_{2}O)}$减小 | |
| D. | 该氨水稀释前后中和盐酸的能力相同 |
分析 A.一水合氨是弱电解质,在水溶液里部分电离,加水促进电离;
B.加水稀释溶液中c(OH-)减小,c(H+)增大;
C.加水稀释氨水,促进一水合氨电离,导致溶液中n(NH4+)增大、n(NH3.H2O)减小;
D.中和盐酸的能力与氨水的物质的量有关.
解答 解:A.一水合氨是弱电解质,在水溶液里部分电离,加水促进电离,将10mLpH=11的氨水加水稀释至1000mL,体积增大100倍,pH变化小于2个单位,即稀释后pH>9,故A错误;
B.加水稀释溶液中c(OH-)减小,温度不变,则水的离子积常数不变,则溶液中c(H+)增大,故B错误;
C.加水稀释氨水,促进一水合氨电离,导致溶液中n(NH4+)增大、n(NH3.H2O)减小,则溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}.{H}_{2}O)}$增大,故C错误;
D.稀释前后溶液中氨水的总物质的量不变,所以稀释前后中和盐酸的能力相同,故D正确;
故选D.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,注意稀释氨水过程中增大一水合氨电离程度但其电离平衡常数不变,溶液中c(H+)增大,为易错点.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
1.下列叙述正确的是( )
| A. | 非金属与金属化合形成离子化合物 | |
| B. | 含有共价键的化合物都是共价化合物 | |
| C. | 非极性键只存在于双原子单质分子里 | |
| D. | 共价化合物中一定存在极性共价键 |
18.分析表中的四个热化学方程式,判断氢气和丙烷的燃烧热分别是( )
| “嫦娥一号”发射火箭燃料 | 液氢(H2) | ①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 ②2H2(l)+O2(l)═2H2O(g)△H=-482.6kJ•mol-1 |
| 北京奥运会“祥云”火炬燃料 | 丙烷(C3H8) | ③C3H8(l)+5O2(g)═3CO2(g)+4H2O(g)△H=-2013.8kJ•mol-1 ④C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2221.5kJ•mol-1 |
| A. | 571.6 kJ•mol-1,2221.5kJ•mol-1 | B. | 241.3 kJ•mol-1,2013.8 kJ•mol-1 | ||
| C. | 285.8 kJ•mol-1,2013.8 kJ•mol-1 | D. | 285.8 kJ•mol-1,2221.5 kJ•mol-1 |
5.某元素B的核电荷数为Z,已知Bn-和Am+的核外具有相同的电子层结构,则A元素的原子序数用Z、n、m来表示,应为( )
| A. | Z+n-m | B. | Z+m+n | C. | Z-n-m | D. | Z-n+m |
15.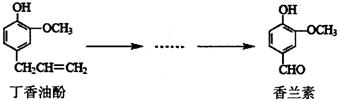 香兰素是重要的香料之一,它可由丁香油酚多步反应合成.有关上述两种化合物的说法正确的是( )
香兰素是重要的香料之一,它可由丁香油酚多步反应合成.有关上述两种化合物的说法正确的是( )
 香兰素是重要的香料之一,它可由丁香油酚多步反应合成.有关上述两种化合物的说法正确的是( )
香兰素是重要的香料之一,它可由丁香油酚多步反应合成.有关上述两种化合物的说法正确的是( )| A. | 在丁香油酚分子中至少有12个原子共平面 | |
| B. | 常温下,1mol丁香油酚可与2molBr2反应 | |
| C. | 1moI香兰素最多能与4mol氢气发生加成反应 | |
| D. | 可用酸性KMnO4溶液检验丁香油酚中是否含有碳碳双键 |
19.某有机物2.3克,完全燃烧后的产物依次通过浓硫酸与NaOH溶液,分别增重2.7克与4.4克,该有机物的分子式是( )
| A. | C2H6O | B. | C2H4O | C. | C2H6 | D. | C2H4 |
20.短周期主族元素X、Y、Z原子序数之和为28,X+与Z2-具有相同的核外电子层结构,Y、Z在同一周期.下列推测不正确的是( )
| A. | 元素Y的最高价氧化物的水化物是强酸 | |
| B. | 三种元素的原子半径:r(X)>r(Z)>r(Y) | |
| C. | Y的简单气态氢化物的热稳定性比Z的强 | |
| D. | 由X与Z两种元素组成的离子化合物不止一种. |
 .
.
 .
.