题目内容
13.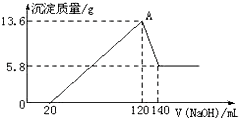 将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应.向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如图.回答下列问题:(不要求写出计算过程)
将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应.向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如图.回答下列问题:(不要求写出计算过程)(1)写出加入如下量的NaOH溶液时的离子方程式:
0-20mLH++OH-═H2O
120-140mLAl(OH)3+OH-═AlO2-+H2O
(2)求合金中Mg与Al的物质的量之比1:1
(3)所加NaOH溶液的物质的量浓度是5mol/L.
分析 (1)由图可知,0-20mL段没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后盐酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O;
120-140mL段是氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+NaOH=NaAlO2+2H2O;
(2)由图可知,氢氧化镁的质量为5.8g,故氢氧化铝沉淀质量为13.6g-5.8g=7.8g,根据质量守恒定律可计算出Mg与Al的物质的量之比;
(3)根据(2)可知氢氧化钠的浓度,然后根据c=$\frac{n}{V}$计算氢氧化钠溶液的浓度.
解答 解:(1)由图可知,0-20mL段没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后盐酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O,离子方程式为:H++OH-═H2O;
120-140mL段是氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+NaOH=NaAlO2+2H2O,反应离子方程式为:Al(OH)3+OH-═AlO2-+H2O,
故答案为:H++OH-═H2O;Al(OH)3+OH-═AlO2-+H2O;
(2)由图可知,氢氧化镁的质量为5.8g,故氢氧化铝沉淀质量为:13.6g-5.8g=7.8g,混合物中Mg的物质的量为:$\frac{5.8g}{58g/mol}$=0.1mol,Al物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,则合金中Mg与Al的物质的量之比为0.1mol:0.1mol=1:1,
故答案为:1:1;
(3)由Al(OH)3+OH-═AlO2-+H2O可知,120-140mL段氢氧化铝完全溶解消耗氢氧化钠为0.1mol,氢氧化钠溶液体积为:140mL-120mL=20mL,故该氢氧化钠溶液的浓度为:c(NaOH)=$\frac{0.1mol}{0.02L}$=5mol/L,
故答案为:5.
点评 本题以图象题的形式考查镁铝化合物性质、混合物的计算,题目难度中等,分析图象各阶段的发生的反应是解题关键,注意利用守恒思想进行计算.

| A. | 非金属与金属化合形成离子化合物 | |
| B. | 含有共价键的化合物都是共价化合物 | |
| C. | 非极性键只存在于双原子单质分子里 | |
| D. | 共价化合物中一定存在极性共价键 |
| A. | 苯不能使酸性KMnO4溶液褪色,属于饱和烃 | |
| B. | 常温下苯是一种易溶于水且密度比水小的液体 | |
| C. | 苯不具有典型的双键,故苯不能发生加成反应 | |
| D. | 苯分子为平面正六边形结构,6个碳原子之间的价键完全相同 |
| “嫦娥一号”发射火箭燃料 | 液氢(H2) | ①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 ②2H2(l)+O2(l)═2H2O(g)△H=-482.6kJ•mol-1 |
| 北京奥运会“祥云”火炬燃料 | 丙烷(C3H8) | ③C3H8(l)+5O2(g)═3CO2(g)+4H2O(g)△H=-2013.8kJ•mol-1 ④C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2221.5kJ•mol-1 |
| A. | 571.6 kJ•mol-1,2221.5kJ•mol-1 | B. | 241.3 kJ•mol-1,2013.8 kJ•mol-1 | ||
| C. | 285.8 kJ•mol-1,2013.8 kJ•mol-1 | D. | 285.8 kJ•mol-1,2221.5 kJ•mol-1 |
| A. | Z+n-m | B. | Z+m+n | C. | Z-n-m | D. | Z-n+m |
| 实验步骤 | 解释或实验结论 |
| (1)称取A 6.9g,升温使其汽化,测其密度是相同条件下CH4的8.625倍. | (1)A的相对分子质量为:138. |
| (2)将此6.9g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和15.4g | (2)A的分子式为:C7H6O3. |
| (3)另取A 6.9g,跟足量的NaHCO3粉末反应,生成1.12L CO2(标准状况),若与足量金属钠反应则生成1.12L H2(标准状况). | (3)用结构简式表示A中含有的官能团: -OH、-COOH. |
| (4)A的核磁共振氢谱显示A有6种氢 | A的结构简式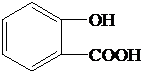 |
(5)写出A与浓溴水反应的方程式: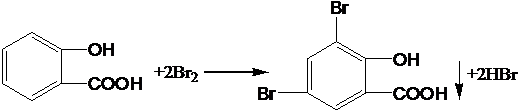 | |
 下列给出了四种烃A、B、C、D的相关信息:
下列给出了四种烃A、B、C、D的相关信息: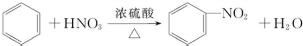 .
.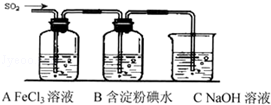 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
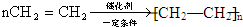 .
.