题目内容
11.下列有关实验的操作和结论正确的是( )| A. | 明矾和漂白粉均可用于自来水的杀菌、消毒 | |
| B. | 用丁达尔实验可以将Al(OH)3胶体和NaCl溶液区分 | |
| C. | CCl4萃取碘水中的I2,先从分液漏斗下口放出有机层,后从分液漏斗下口放出水层 | |
| D. | 浓盐酸与MnO2反应制备纯净Cl2,气体产物先通过浓硫酸,后通过饱和食盐水 |
分析 A.明矾及氢氧化铝没有强氧化性,利用明矾水解生成的氢氧化铝胶体吸附性水中悬浮物而净水;
B.胶体具有丁达尔效应,溶液没有丁达尔效应;
C.分液时,下层液体从下口倒出,上层液体从上口倒出;
D.应该将气体先通入饱和食盐水中后通入浓硫酸中.
解答 解:A.明矾及氢氧化铝没有强氧化性,利用明矾水解生成的氢氧化铝胶体吸附性水中悬浮物而净水,漂白粉中的次氯酸钙具有强氧化性,能杀菌消毒,所以二者原理不同,故A错误;
B.胶体具有丁达尔效应,溶液没有丁达尔效应,氢氧化铝胶体具有丁达尔效应、氯化钠溶液没有,所以可以用丁达尔实验区别二者,故B正确;
C.分液时,下层液体从下口倒出,为防止分离的物质不纯,则上层液体从上口倒出,故C错误;
D.应该将气体先通入饱和食盐水中后通入浓硫酸中,否则得到的氯气中含有水蒸气,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质分离提纯、物质鉴别、实验基本操作等知识点,明确实验原理及物质性质、实验操作规范性及先后顺序是解本题关键,注意A中原理的区别,题目难度不大.

练习册系列答案
相关题目
1.下列叙述正确的是( )
| A. | 非金属与金属化合形成离子化合物 | |
| B. | 含有共价键的化合物都是共价化合物 | |
| C. | 非极性键只存在于双原子单质分子里 | |
| D. | 共价化合物中一定存在极性共价键 |
19.某有机物2.3克,完全燃烧后的产物依次通过浓硫酸与NaOH溶液,分别增重2.7克与4.4克,该有机物的分子式是( )
| A. | C2H6O | B. | C2H4O | C. | C2H6 | D. | C2H4 |
16.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
| A. | W与X形成的化合物溶于水后溶液呈碱性 | |
| B. | 简单离子半径:W<X<Z | |
| C. | 气态氢化物的热稳定性:W<Y | |
| D. | 最高价氧化物的水化物的酸性:Y>Z |
3.有机物A可用于制备常见的解热镇痛药阿司匹林.纯净的A为白色结晶性粉末,易溶于水.为研究A的组成与结构,进行了如下实验:
| 实验步骤 | 解释或实验结论 |
| (1)称取A 6.9g,升温使其汽化,测其密度是相同条件下CH4的8.625倍. | (1)A的相对分子质量为:138. |
| (2)将此6.9g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和15.4g | (2)A的分子式为:C7H6O3. |
| (3)另取A 6.9g,跟足量的NaHCO3粉末反应,生成1.12L CO2(标准状况),若与足量金属钠反应则生成1.12L H2(标准状况). | (3)用结构简式表示A中含有的官能团: -OH、-COOH. |
| (4)A的核磁共振氢谱显示A有6种氢 | A的结构简式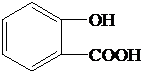 |
(5)写出A与浓溴水反应的方程式: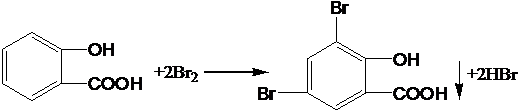 | |
20.短周期主族元素X、Y、Z原子序数之和为28,X+与Z2-具有相同的核外电子层结构,Y、Z在同一周期.下列推测不正确的是( )
| A. | 元素Y的最高价氧化物的水化物是强酸 | |
| B. | 三种元素的原子半径:r(X)>r(Z)>r(Y) | |
| C. | Y的简单气态氢化物的热稳定性比Z的强 | |
| D. | 由X与Z两种元素组成的离子化合物不止一种. |

 .
. 取1.38g由C、H、O三种元素组成的有机物A,在足量氧气中完全燃烧,若将燃烧产物通过碱石灰,碱石灰质量增加4.42g;若将燃烧产物通过浓硫酸,浓硫酸质量增加0.9g;已知:A的蒸气对氢气的相对密度为69.
取1.38g由C、H、O三种元素组成的有机物A,在足量氧气中完全燃烧,若将燃烧产物通过碱石灰,碱石灰质量增加4.42g;若将燃烧产物通过浓硫酸,浓硫酸质量增加0.9g;已知:A的蒸气对氢气的相对密度为69.