题目内容
14.下列实验装置图正确的是( )| A. |  实验室制备及收集乙烯 | B. |  石油分馏 | ||
| C. |  实验室制硝基苯 | D. |  实验室制乙酸乙酯 |
分析 A.乙烯密度小于空气,应该采用向下排空气法收集;
B.蒸馏时,温度计测量馏分温度;
C.实验室用苯和浓硝酸在浓硫酸作催化剂、加热55-60℃制备硝基苯;
D.实验室制取乙酸乙酯时,导气管不能伸入饱和碳酸钠溶液中.
解答 解:A.乙烯密度小于空气,应该采用向下排空气法收集,但因为乙烯不易溶于水且乙烯密度接近空气密度,最好采用排水法收集,故A错误;
B.蒸馏时,温度计测量馏分温度,则温度计水银球应该位于蒸馏烧瓶支管口处,故B错误;
C.实验室用苯和浓硝酸在浓硫酸作催化剂、加热55-60℃制备硝基苯,该实验操作正确,故C正确;
D.实验室制取乙酸乙酯时,导气管不能伸入饱和碳酸钠溶液中,否则易产生倒吸现象,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及物质分离提纯、气体及物质制备等知识点,明确实验原理及物质性质差异性是解本题关键,注意BC中温度计水银球位置,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.某元素B的核电荷数为Z,已知Bn-和Am+的核外具有相同的电子层结构,则A元素的原子序数用Z、n、m来表示,应为( )
| A. | Z+n-m | B. | Z+m+n | C. | Z-n-m | D. | Z-n+m |
9.X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子数是最内层电子数的2倍;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子形成的-2价简单阴离子的核外电子排布与K+相同.下列有关这些元素性质的说法一定正确的是( )
| A. | X元素的氢化物的水溶液显碱性 | |
| B. | Y元素最高价氧化物的晶体具有很高的熔点和沸点 | |
| C. | Z元素的单质在一定条件下能与X元素的单质反应 | |
| D. | W元素的氧化物对应水化物均为强酸 |
19.某有机物2.3克,完全燃烧后的产物依次通过浓硫酸与NaOH溶液,分别增重2.7克与4.4克,该有机物的分子式是( )
| A. | C2H6O | B. | C2H4O | C. | C2H6 | D. | C2H4 |
3.有机物A可用于制备常见的解热镇痛药阿司匹林.纯净的A为白色结晶性粉末,易溶于水.为研究A的组成与结构,进行了如下实验:
| 实验步骤 | 解释或实验结论 |
| (1)称取A 6.9g,升温使其汽化,测其密度是相同条件下CH4的8.625倍. | (1)A的相对分子质量为:138. |
| (2)将此6.9g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和15.4g | (2)A的分子式为:C7H6O3. |
| (3)另取A 6.9g,跟足量的NaHCO3粉末反应,生成1.12L CO2(标准状况),若与足量金属钠反应则生成1.12L H2(标准状况). | (3)用结构简式表示A中含有的官能团: -OH、-COOH. |
| (4)A的核磁共振氢谱显示A有6种氢 | A的结构简式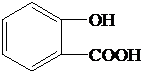 |
(5)写出A与浓溴水反应的方程式: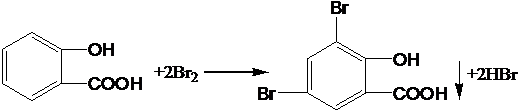 | |
7.下列反应中,水作氧化剂的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | CuO+H2 $\frac{\underline{\;高温\;}}{\;}$ Cu+H2O | D. | Na2O+H2O═2NaOH |
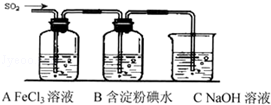 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
 .
. 取1.38g由C、H、O三种元素组成的有机物A,在足量氧气中完全燃烧,若将燃烧产物通过碱石灰,碱石灰质量增加4.42g;若将燃烧产物通过浓硫酸,浓硫酸质量增加0.9g;已知:A的蒸气对氢气的相对密度为69.
取1.38g由C、H、O三种元素组成的有机物A,在足量氧气中完全燃烧,若将燃烧产物通过碱石灰,碱石灰质量增加4.42g;若将燃烧产物通过浓硫酸,浓硫酸质量增加0.9g;已知:A的蒸气对氢气的相对密度为69.