题目内容
6. 已知A(g)+B(g)?C(g)+D(s)反应的平衡常数与温度的关系如下:
已知A(g)+B(g)?C(g)+D(s)反应的平衡常数与温度的关系如下:| 温度℃ | 700 | 800 | 880 | 1000 | 1200 |
| 平衡常数 | 1.0 | 10.0 | 12.5 | 16.1 | 17.7 |
(1)该反应的平衡常数表达式K=$\frac{c(C)}{c(A)c(B)}$,△H>0(填“>、<、或=”);
(2)800℃时,向一个5L的密闭容器中充入0.4molA和0.7molB,若反应初始2mim内A的平均反应速率为0.01mol•L-1•min-1,则2min时c(A)=0.06mol•L-1,C的物质的量为0.1mol;若经过一段时间后,反应达到平衡时再向容器中充入0.4molA,则再次达到平衡后A的百分含量与第一次平衡相比增大(填“增大”、“减小”、或“不变”)
(3)下列选项中能作为判断反应达到平衡的依据有ad
a.压强不随时间改变
b.v(A):v(b)=1:1
c.单位时间内消耗A和B的物质的量相等
d.C的百分含量保持不变
(4)880℃时,反应 C(g)+D(s)?A(g)+B(g)的平衡常数的值为0.08.
(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),则该此时的温度为700℃.
(6)图是1000℃时容器中A的物质的量的变化曲线,请在图中补画出该反应在1200℃时A的物质的量的变化曲线图
 .
.
分析 (1)K为生成物浓度幂之积与反应物浓度幂之积的比,由表格数据可知,温度越高,K越大;
(2)800℃时,K=10.0,初始2mim内A的平均反应速率为0.01mol•L-1•min-1,转化的A为0.02mol/L,则
A(g)+B(g)?C(g)+D(s)
开始 0.08 0.14 0
转化 0.02 0.02 0.02
2min 0.06 0.12 0.02
结合Qc与K的关系判断是否为平衡状态,再结合平衡常数不变计算A的平衡含量;
(3)结合平衡的特征“等、定”及衍生的物理量判定平衡;
(4)880℃时,互为相反的两个反应的K互为倒数关系;
(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),可知K=$\frac{c(C)}{c(A)c(B)}$=1;
(6)升高温度,反应速率加快,平衡正向移动.
解答 解:(1)由A(g)+B(g)?C(g)+D(s),纯固体不能代入K的表达式中,K=$\frac{c(C)}{c(A)c(B)}$,由表格数据可知,温度越高,K越大,则正反应为吸热反应,△H>0,
故答案为:$\frac{c(C)}{c(A)c(B)}$;>;
(2)800℃时,K=10.0,初始2mim内A的平均反应速率为0.01mol•L-1•min-1,转化的A为0.02mol/L,则
A(g)+B(g)?C(g)+D(s)
开始 0.08 0.14 0
转化 0.02 0.02 0.02
2min 0.06 0.12 0.02
则2min时c(A)=0.06mol•L-1,C的物质的量为0.02mol/L×5L=0.1mol;此时,Qc=$\frac{0.02}{0.06×0.12}$=2.78<K,平衡正向移动,
A(g)+B(g)?C(g)+D(s)
开始 0.08 0.14 0
转化 x x x
平衡 0.08-x 0.14-x x
$\frac{x}{(0.08-x)(0.14-x)}$=10,
解得x=0.04mol/L,
平衡后A的百分含量为$\frac{0.04}{0.04+0.1+0.04}$×100%=22.2%,
反应达到平衡时再向容器中充入0.4molA,平衡正向移动,则
A(g)+B(g)?C(g)+D(s)
开始 0.04+0.08 0.1 0.04
转化 x x x
平衡 0.12-x 0.1-x 0.04+x
$\frac{0.04+x}{(0.12-x)(0.1-x)}$=10.0,
解得x=0.027mol/L,
平衡时A的含量为$\frac{0.12-0.027}{0.12+0.1+0.04-0.027}$×100%=39.9%,
则再次达到平衡后A的百分含量与第一次平衡相比增大,
故答案为:0.06;0.1;增大;
(3)a.该反应为气体体积不等的反应,压强不随时间改变,达到平衡状态,故选;
b.v(A):v(b)=1:1始终存在,不能判断达到平衡状态,故不选;
c.单位时间内消耗A和B的物质的量相等,只体现正反应速率关系,不能判定平衡,故不选;
d.C的百分含量保持不变,可知浓度不变,为平衡状态,故选;
故答案为:ad;
(4)880℃时,A(g)+B(g)?C(g)+D(s)反应的平衡常数K=12.5,互为相反的两个反应的K互为倒数关系,则880℃时,反应 C(g)+D(s)?A(g)+B(g)的平衡常数的值为$\frac{1}{12.5}$=0.08,故答案为:0.08;
(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),可知K=$\frac{c(C)}{c(A)c(B)}$=1,则该此时的温度为700℃,故答案为:700;
(6)升高温度,反应速率加快,平衡正向移动,平衡时A的物质的量比原平衡的小,在1200℃时A的物质的量的变化曲线图为 ,
,
故答案为: .
.
点评 本题考查化学平衡的计算,为高频考点,把握表中数据、平衡三段法、K的计算、平衡判定为解答的关键,侧重分析与计算能力的考查,注意(2)为解答的难点,题目难度中等.

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案| A. | O2是还原剂 | B. | NH3是氧化剂 | C. | O2得到电子 | D. | NH3发生还原反应 |
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右下图.下列有关该氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右下图.下列有关该氢氧燃料电池的说法不正确的是( )| A. | 该电池工作时将电能转化为化学能 | B. | 电子从电极b经外电路流向电极a | ||
| C. | 该电池中的电极b是正极 | D. | 在电极a上发生氧化反应 |
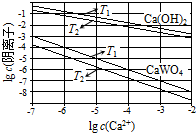 已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应
已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)?CaWO4(s)+2OH-(aq).
(1)如图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线.
①计算T1时KSP(CaWO4)=1×10-10.
②T1< T2(填“>”“=”或“<”).
(2)反应Ⅰ的平衡常数K理论值如表:
| 温度/℃ | 25 | 50 | 90 | 100 |
| K | 79.96 | 208.06 | 222.88 | 258.05 |
②该反应的△H>0(填“>”“=”或“<”).
(3)常温下向较浓AlCl3的溶液中不断通入HCl气体,可析出大量AlCl3•6H2O晶体,结合化学平衡移动原理解释析出晶体的原因:AlCl3饱和溶液中存在溶解平衡:AlCl3•6H2O(s)═Al3+(aq)+3Cl-(aq)+6H2O(l),通入HCl气体使溶液中c(Cl-)增大,平衡向析出固体的方向移动从而析出AlCl3•6H2O晶体.
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=$\frac{3△{H}_{1}+2△{H}_{2}}{5}$.(请用含有△H1、△H2的式子表示)
(2)若NH3?$\frac{1}{2}$N2+$\frac{3}{2}$H2 K=a,则N2+3H2?2NH3 K′=$\frac{1}{{a}^{2}}$.(用含a的式子表示)
(3)在体积为3L的恒容密闭容器中,合成氨N2+3H2?2NH3实验,投入4mol N2和9mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
①则T1<T2(填“>”、“<”或“=”)
②在T2下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)=0.1mol•L-1•min-1,平衡时N2的转化率α(N2)=25%.
③下列图象分别代表焓变(△H)、混合气体平均相对分子质量($\overline{M}$)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是BC.
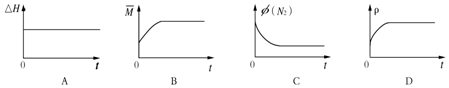
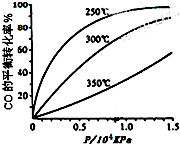 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.