题目内容
13.根据下列化合物:①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3•H2O、⑧H2O.回答下列问题.(1)NH4Cl溶液显酸性,用离子方程式表示原因NH4++H2O?NH3•H2O+H+,其溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-)
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=10-3mol/L在pH=3的CH3COOH溶液中,水电离出来的c(H+)=10-11 mol/L.
(3)已知纯水中存在如下平衡:H2O?H++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是D(填字母序号).
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH和⑦NH3•H2O分别加水稀释m倍、n倍,稀 释后两种溶液的pH仍相等,则m<n(填“<”、“>”或“=”).
(5)①NaCl、②NaOH、③HCl、⑤CH3COONa、⑥CH3COOH,这5种溶液的物质的量浓度相同,则这5种溶液按 pH由大到小的顺序为:②>⑤>①>⑥>③(填序号)
分析 (1)NH4Cl为强酸弱碱盐,水解呈酸性;
(2)CH3COONa为强碱弱酸盐,水解促进水的电离,醋酸抑制水的电离;
(3)欲使平衡向右移动,且所得溶液显酸性,可加入能与氢氧根离子反应的物质;
(4)一水合氨为弱电解质,不能完全电离,加水促进电离;
(5)溶液中氢离子浓度越大,则其pH越小,按照溶液中氢离子浓度由小到大顺序进行排列.
解答 解:(1)氯化铵为强酸弱碱盐,水解呈酸性,铵根离子水解的离子方程式为NH4++H2O?H++NH3•H2O,铵根离子水解,则(Cl-)>c(NH4+),所以溶液中离子浓度关系为:(Cl-)>c(NH4+)>c(H+)>c(OH-);
故答案为:酸;NH4++H2O?H++NH3•H2O;(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)CH3COONa为强碱弱酸盐,pH=11的CH3COONa溶液中,c(OH-)=10-3mol/L,c(H+)=10-11mol/L,CH3COONa 中氢离子和氢氧根离子都是水电离的,则水电离出来的c(OH-)为10-3mol/L;在pH=3的CH3COOH溶液中,c(OH-)=10-11mol/L,酸中的氢氧根离子由水电离,则水电离出来的c(OH-)=c(H+)为10-11mol/L,
故答案为:10-3mol/L;10-11mol/L;
(3)A.向水中加入NaHSO4固体,溶液于电离出氢离子,平衡向左移,溶液呈酸性,故A错误;
B.向水中加入Na2CO3固体,Na2CO3是强碱弱酸盐,水解对水的电离起促进作用,平衡向右移,溶液呈碱性,故B错误;
C.加热至100℃,促进水的电离,溶液仍呈中性,故C错误;
D.向水中加入(NH4)2SO4固体,NH4)2SO4是强酸弱碱盐溶液水解呈酸性,水解对水的电离起促进作用,平衡向右移,故D正确;
故答案为:D;
(4)氨水为弱电解质,不能完全电离,如稀释相等体积,氨水溶液pH大,如稀释后溶液pH相同,则氨水应加入较多水,
故答案为:<;
(5)①NaCl ②NaOH ③HCl ⑤CH3COONa、⑥CH3COOH,
显示碱性的为:②NaOH、⑤CH3COONa,氢氧化钠为强碱,CH3COONa为盐,所以pH②>⑤;
显示中性的为①NaCl,pH=7;
显示酸性的为:③HCl ⑥CH3COOH,浓度相同时,盐酸为强酸,氢离子浓度最大,醋酸为一元弱酸,氢离子浓度小于盐酸,所以两种酸性溶液的pH大小关系为:⑥>③,故物质的量浓度相同时,按pH由大到小的顺序为:②>⑤>①>⑥>③;
故答案为:②>⑤>①>⑥>③.
点评 本题考查了离子浓度大小比较、水的电离及其影响因素、弱电解质的电离平衡等知识,题目难度中等,试题涉及的题量较大,充分考查了学生对所学知识的掌握情况,明确溶液中水电离的氢离子浓度大小的计算方法.

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案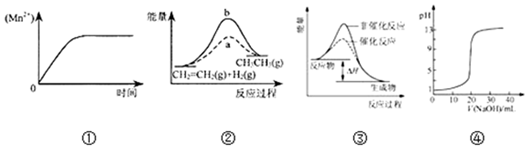
| A. | 图①表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混 合时,n(Mn2+) 随时间的变化 | |
| B. | 图②中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 | |
| C. | 图③表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| D. | 图④表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得到的滴定曲线 |
| A. | 增大压强,化学平衡不一定移动 | |
| B. | 通入氦气,化学平衡一定不发生移动 | |
| C. | 增加X或Y的物质的量,化学平衡一定发生移动 | |
| D. | 其它条件不变,升高温度,化学平衡一定发生移动 |
| A. | c(HCO3-)>c(H2CO3) | B. | c(OH-)=2c(H+) | ||
| C. | c(Na+)=2c(CO32-) | D. | c(Na+)<c(CO32-)+c(HCO3-) |
| A. | 维生素是参与生物生长发育和新陈代谢所必需的一类高分子化合物 | |
| B. | 维生素C溶于水,溶液显酸性 | |
| C. | 生吃新鲜蔬菜要比熟吃时维生素C的损失小 | |
| D. | 含维生素C能使蓝色的碘的淀粉溶液褪色 |
 已知A(g)+B(g)?C(g)+D(s)反应的平衡常数与温度的关系如下:
已知A(g)+B(g)?C(g)+D(s)反应的平衡常数与温度的关系如下:| 温度℃ | 700 | 800 | 880 | 1000 | 1200 |
| 平衡常数 | 1.0 | 10.0 | 12.5 | 16.1 | 17.7 |
(1)该反应的平衡常数表达式K=$\frac{c(C)}{c(A)c(B)}$,△H>0(填“>、<、或=”);
(2)800℃时,向一个5L的密闭容器中充入0.4molA和0.7molB,若反应初始2mim内A的平均反应速率为0.01mol•L-1•min-1,则2min时c(A)=0.06mol•L-1,C的物质的量为0.1mol;若经过一段时间后,反应达到平衡时再向容器中充入0.4molA,则再次达到平衡后A的百分含量与第一次平衡相比增大(填“增大”、“减小”、或“不变”)
(3)下列选项中能作为判断反应达到平衡的依据有ad
a.压强不随时间改变
b.v(A):v(b)=1:1
c.单位时间内消耗A和B的物质的量相等
d.C的百分含量保持不变
(4)880℃时,反应 C(g)+D(s)?A(g)+B(g)的平衡常数的值为0.08.
(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),则该此时的温度为700℃.
(6)图是1000℃时容器中A的物质的量的变化曲线,请在图中补画出该反应在1200℃时A的物质的量的变化曲线图
 .
. 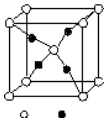 周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中未成对电子有3个,C的最外层电子数为其内层电子数的3倍,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题;
周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中未成对电子有3个,C的最外层电子数为其内层电子数的3倍,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题;