题目内容
11. 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右下图.下列有关该氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右下图.下列有关该氢氧燃料电池的说法不正确的是( )| A. | 该电池工作时将电能转化为化学能 | B. | 电子从电极b经外电路流向电极a | ||
| C. | 该电池中的电极b是正极 | D. | 在电极a上发生氧化反应 |
分析 氢氧燃料电池工作时,是把化学能转变为电能,通入氢气的一极为电源的负极,发生氧化反应,电极反应式为H2-2e-=2H+,通入氧气的一极为原电池的正极,电极反应式为O2+4H++4e-=2H2O,电子由负极经外电路流向正极.
解答 解:A、该电池工作时化学能转化为电能,故A错误;
B、原电池工作时,电子由负极经外电路流向正极,即电子由a经外电路流向电极b,故B错误;
C、氢氧燃料电池中,H2在负极上a被氧化,O2在正极b上被还原,所以该电池中电极b是正极,故C正确;
D、氢氧燃料电池中,通入氢气的一极a为电源的负极,发生氧化反应,故D正确;
故选AB.
点评 本题考查氢氧燃料电池的工作原理,题目难度不大,注意正负极的判断及电子流动方向.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
1.对于容积不变的密闭容器发生中的可逆反应:mX(g)+nY(s)?pZ(g)△H<0,达到平衡后,改变条件,下列表述不正确的是( )
| A. | 增大压强,化学平衡不一定移动 | |
| B. | 通入氦气,化学平衡一定不发生移动 | |
| C. | 增加X或Y的物质的量,化学平衡一定发生移动 | |
| D. | 其它条件不变,升高温度,化学平衡一定发生移动 |
2.下列有关维生素的说法中不正确的是( )
| A. | 维生素是参与生物生长发育和新陈代谢所必需的一类高分子化合物 | |
| B. | 维生素C溶于水,溶液显酸性 | |
| C. | 生吃新鲜蔬菜要比熟吃时维生素C的损失小 | |
| D. | 含维生素C能使蓝色的碘的淀粉溶液褪色 |
6.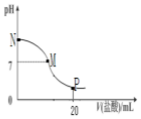 向10.0mL0.10mol•L-1氨水中滴入0.1mol•L-1盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体移出),下列有关叙述正确的是( )
向10.0mL0.10mol•L-1氨水中滴入0.1mol•L-1盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体移出),下列有关叙述正确的是( )
 向10.0mL0.10mol•L-1氨水中滴入0.1mol•L-1盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体移出),下列有关叙述正确的是( )
向10.0mL0.10mol•L-1氨水中滴入0.1mol•L-1盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体移出),下列有关叙述正确的是( )| A. | M-N间一定存在c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | M点对应的盐酸体积为10.0mL | |
| C. | pH=7溶液中存在c(Cl-)=c(NH4+)=c(OH-)=c(H+) | |
| D. | p点处的溶液中存在:2 c(NH4+)+2c(NH3•H2O)=c(Cl-) |
6. 已知A(g)+B(g)?C(g)+D(s)反应的平衡常数与温度的关系如下:
已知A(g)+B(g)?C(g)+D(s)反应的平衡常数与温度的关系如下:
回答下列问题:
(1)该反应的平衡常数表达式K=$\frac{c(C)}{c(A)c(B)}$,△H>0(填“>、<、或=”);
(2)800℃时,向一个5L的密闭容器中充入0.4molA和0.7molB,若反应初始2mim内A的平均反应速率为0.01mol•L-1•min-1,则2min时c(A)=0.06mol•L-1,C的物质的量为0.1mol;若经过一段时间后,反应达到平衡时再向容器中充入0.4molA,则再次达到平衡后A的百分含量与第一次平衡相比增大(填“增大”、“减小”、或“不变”)
(3)下列选项中能作为判断反应达到平衡的依据有ad
a.压强不随时间改变
b.v(A):v(b)=1:1
c.单位时间内消耗A和B的物质的量相等
d.C的百分含量保持不变
(4)880℃时,反应 C(g)+D(s)?A(g)+B(g)的平衡常数的值为0.08.
(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),则该此时的温度为700℃.
(6)图是1000℃时容器中A的物质的量的变化曲线,请在图中补画出该反应在1200℃时A的物质的量的变化曲线图 .
.
 已知A(g)+B(g)?C(g)+D(s)反应的平衡常数与温度的关系如下:
已知A(g)+B(g)?C(g)+D(s)反应的平衡常数与温度的关系如下:| 温度℃ | 700 | 800 | 880 | 1000 | 1200 |
| 平衡常数 | 1.0 | 10.0 | 12.5 | 16.1 | 17.7 |
(1)该反应的平衡常数表达式K=$\frac{c(C)}{c(A)c(B)}$,△H>0(填“>、<、或=”);
(2)800℃时,向一个5L的密闭容器中充入0.4molA和0.7molB,若反应初始2mim内A的平均反应速率为0.01mol•L-1•min-1,则2min时c(A)=0.06mol•L-1,C的物质的量为0.1mol;若经过一段时间后,反应达到平衡时再向容器中充入0.4molA,则再次达到平衡后A的百分含量与第一次平衡相比增大(填“增大”、“减小”、或“不变”)
(3)下列选项中能作为判断反应达到平衡的依据有ad
a.压强不随时间改变
b.v(A):v(b)=1:1
c.单位时间内消耗A和B的物质的量相等
d.C的百分含量保持不变
(4)880℃时,反应 C(g)+D(s)?A(g)+B(g)的平衡常数的值为0.08.
(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),则该此时的温度为700℃.
(6)图是1000℃时容器中A的物质的量的变化曲线,请在图中补画出该反应在1200℃时A的物质的量的变化曲线图
 .
.
4.室温下向10mL 0.1mol/L的醋酸溶液中加水稀释后,下列说法正确的是( )
| A. | 溶液中导电粒子的数目减小 | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$不变 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 醋酸的电离常数K随醋酸浓度减小而减小 |
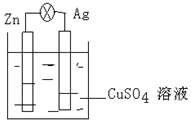 (1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,该电极上发生的电极反应式为Zn-2e-=Zn2+,银电极上发生的是还原反应(“氧化”或“还原”).
(1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,该电极上发生的电极反应式为Zn-2e-=Zn2+,银电极上发生的是还原反应(“氧化”或“还原”). .
.