题目内容
1. 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.(1)NO2可用水吸收,相应的化学反应方程式为3NO2+H2O=NO+2HNO3.利用反应6NO2+8NH3$?_{加热}^{催化剂}$7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是6.72L.
(2)已知:反应NO2(g)+SO2(g)═SO3(g)+NO(g)的△H=-41.8kJ•mol-1.
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是bc.
a、体系压强保持不变 b、混合气体颜色保持不变
c、SO2和NO的体积比保持不变 d、每消耗1mol SO3的同时生成1molNO2
e、混合气体的密度不变 f、混合气体的平均分子量不变
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=$\frac{8}{3}$.
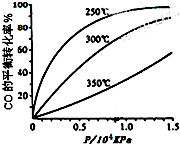
(3)CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)═CH3OH(g).CO在不同
温度下的平衡转化率与压强的关系如图所示.该△H<0(填“>”或“<”).实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失.
分析 (1)根据物质与水的反应物与生成物来书写化学反应方程式,再利用氧化还原反应中电子转移计算,然后计算标准状况下气体的体积;
(2)可逆反应达到平衡状态时,正逆反应速率相等,各组分的浓度不变,据此进行判断;利用三段法计算平衡时的浓度来计算化学平衡常数;
(3)利用化学平衡的影响因素和工业生产的关系来分析.
解答 解:(1)NO2与H2O反应的方程式为:3NO2+H2O═2HNO3+NO;6NO2+8NH3═7N2+12H2O,当反应中有1 mol NO2参加反应时,共转移了4 mol电子,故转移1.2mol电子时,消耗的NO2为:1.2÷4×22.4L=6.72L,
故答案为:3NO2+H2O=NO+2HNO3;6.72;
(2)a.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故a错误;
b.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故b正确;
c.SO3和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故c错误;
d.物质的量之比等于化学计量数之比,则每消耗1mol SO3的同时生成1molNO2,不能判断是否达到平衡状态,故d错误;
设加入的二氧化氮的物质的量为a,则二氧化硫的为2a,
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始时(mol) 1a 2a 0 0
转化时(mol) x x x x
平衡时(mol) a-x 2a-x x x
则(a-x):(2a-x)=1:6,x=$\frac{4a}{5}$,则平衡时,c( NO2)=$\frac{a-x}{V}$mol/L=$\frac{a}{5V}$mol/L,c(SO2)=$\frac{2a-x}{V}$mol/L=$\frac{6a}{5V}$mol/L,c(SO3)=c(NO)=$\frac{4a}{5V}$mol/L,
则该反应的平衡常数为:K=$\frac{\frac{4a}{5V}×\frac{4a}{5V}}{\frac{a}{5V}×\frac{6a}{5V}}$=$\frac{8}{3}$,
故答案为:bc;$\frac{8}{3}$;
(3)由图可知,温度升高,CO的转化率降低,平衡向逆反应方向移动,故逆反应是吸热反应,正反应是放热反应,△H<0;压强大,有利于加快反应速率,有利于使平衡正向移动,但压强过大,需要的动力大,对设备的要求也高,故选择250℃、1.3×104kPa左右的条件.因为在250℃、压强为1.3×104 kPa时,CO的转化率已较大,再增大压强,CO的转化率变化不大,没有必要再增大压强.
故答案为:<,在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失.
点评 该题将元素化合物与能量变化、化学平衡等知识柔和在一起进行考察,充分体现了高考的综合性,第(3)容易出错,需认真分析图象,注意图象的变化趋势及纵横坐标的含义,从而得出正确结论.

| A. | c(HCO3-)>c(H2CO3) | B. | c(OH-)=2c(H+) | ||
| C. | c(Na+)=2c(CO32-) | D. | c(Na+)<c(CO32-)+c(HCO3-) |
| A. | 强电解质的水溶液一定比弱电解质溶液的导电能力强 | |
| B. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| C. | 强电解质的水溶液中不存在溶质分子 | |
| D. | 不溶性盐都是弱电解质,可溶性盐都是强电解质 |
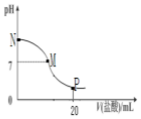 向10.0mL0.10mol•L-1氨水中滴入0.1mol•L-1盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体移出),下列有关叙述正确的是( )
向10.0mL0.10mol•L-1氨水中滴入0.1mol•L-1盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体移出),下列有关叙述正确的是( )| A. | M-N间一定存在c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | M点对应的盐酸体积为10.0mL | |
| C. | pH=7溶液中存在c(Cl-)=c(NH4+)=c(OH-)=c(H+) | |
| D. | p点处的溶液中存在:2 c(NH4+)+2c(NH3•H2O)=c(Cl-) |
| A. | 100g/mol | B. | 100g | C. | 55g/mol | D. | 55g |
 已知A(g)+B(g)?C(g)+D(s)反应的平衡常数与温度的关系如下:
已知A(g)+B(g)?C(g)+D(s)反应的平衡常数与温度的关系如下:| 温度℃ | 700 | 800 | 880 | 1000 | 1200 |
| 平衡常数 | 1.0 | 10.0 | 12.5 | 16.1 | 17.7 |
(1)该反应的平衡常数表达式K=$\frac{c(C)}{c(A)c(B)}$,△H>0(填“>、<、或=”);
(2)800℃时,向一个5L的密闭容器中充入0.4molA和0.7molB,若反应初始2mim内A的平均反应速率为0.01mol•L-1•min-1,则2min时c(A)=0.06mol•L-1,C的物质的量为0.1mol;若经过一段时间后,反应达到平衡时再向容器中充入0.4molA,则再次达到平衡后A的百分含量与第一次平衡相比增大(填“增大”、“减小”、或“不变”)
(3)下列选项中能作为判断反应达到平衡的依据有ad
a.压强不随时间改变
b.v(A):v(b)=1:1
c.单位时间内消耗A和B的物质的量相等
d.C的百分含量保持不变
(4)880℃时,反应 C(g)+D(s)?A(g)+B(g)的平衡常数的值为0.08.
(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),则该此时的温度为700℃.
(6)图是1000℃时容器中A的物质的量的变化曲线,请在图中补画出该反应在1200℃时A的物质的量的变化曲线图
 .
.  硼及其化合物在工业中有重要应用,已知以下几个反应:
硼及其化合物在工业中有重要应用,已知以下几个反应:Ⅰ.BCl3(g)+3H2O(I)=H3BO3(s)+3HCl(g)△H1
Ⅱ.B2O3(s)+3C(s)+3Cl2(g)?2BCl3(g)+3CO(g)△H2
Ⅲ.H3BO3(aq)+H2O(I)?[B(OH)4]-(aq)+H+(aq)
Ⅳ.H3BO3(I)+3CH3OH(I)?B(OCH3)3(I)+3H2O(I)
(1)已知硼酸的结构是:
 ,反应Ⅰ中相关化学键键能数据如下:
,反应Ⅰ中相关化学键键能数据如下:| 化学键 | H-O | H-Cl | B-O | B-Cl |
| E(KJ•mol-1) | 465 | 431 | 809 | 427 |
(2)已知△H2>0,既能使反应Ⅱ平衡向正反应方向移动,又能加快反应速率的措施是bc.
a.加压 b.升温 c.增大Cl2的浓度 d.移走部分BCl3 e.加入适当的催化剂 f.增大焦炭的量
(3)写出反应Ⅲ的平衡常数表达式K=$\frac{[[B(OH){\;}_{4}]{\;}^{-}][H{\;}^{+}]}{[{H}_{3}B{O}_{3}]}$;写出阴离子[B(OH)4]-的电子式:
 .
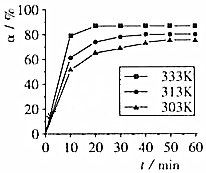
.(4)在反应Ⅳ中,H3BO3的转化率在不同温度下随反应时间(t)的变化如图,若T=333K,初始c(H3BO3)=1mol•L-1,则0~10min的反应速率v(H3BO3)=0.08mol/(L•min);40min达到平衡后,改变温度为T,c(H3BO3 )以0.005mol•L-1•min-1的平均速率降低,经过10min又达到平衡,则T>333K(用“>”、“<”、“=”填空),温度对该反应的速率和平衡移动的影响是升高温度反应速率加快,平衡向正向移动.
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、Cu2+、SO42-、Cl- | D. | Na+、H+、Cl-、CO32- |
 .
.