题目内容
11. 已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应
已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)?CaWO4(s)+2OH-(aq).
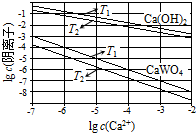
(1)如图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线.
①计算T1时KSP(CaWO4)=1×10-10.
②T1< T2(填“>”“=”或“<”).
(2)反应Ⅰ的平衡常数K理论值如表:
| 温度/℃ | 25 | 50 | 90 | 100 |
| K | 79.96 | 208.06 | 222.88 | 258.05 |
②该反应的△H>0(填“>”“=”或“<”).
(3)常温下向较浓AlCl3的溶液中不断通入HCl气体,可析出大量AlCl3•6H2O晶体,结合化学平衡移动原理解释析出晶体的原因:AlCl3饱和溶液中存在溶解平衡:AlCl3•6H2O(s)═Al3+(aq)+3Cl-(aq)+6H2O(l),通入HCl气体使溶液中c(Cl-)增大,平衡向析出固体的方向移动从而析出AlCl3•6H2O晶体.
分析 (1)①T1时KSP(CaWO4)=c(Ca2+)•c(WO42-),根据表中该温度下离子的浓度代入计算;
②沉淀的溶解平衡是吸热的过程,温度高,溶度积常数大;
(2)①反应平衡常数K等于生成物平衡浓度系数次方之积和反应物平衡浓度系数次方之积;
②对于吸热反应,温度高,K越大,反之越低;
(3)根据浓度对反应平衡移动的影响:增大产物浓度,平衡逆向移动来回答.
解答 解:(1)①T1时KSP(CaWO4)=c(Ca2+)•c(WO42-)=1×10-5×1×10-5=1×10-10,故答案为:1×10-10;
②沉淀的溶解平衡是吸热的过程,温度高,溶度积常数大,根据表中数据,可以看出下的Ksp较大,所以T1<T2,故答案为:<;
(2)①反应平衡常数K等于生成物平衡浓度系数次方之积和反应物平衡浓度系数次方之积,即K=$\frac{{c}^{2}(O{H}^{-})}{c(W{{O}_{4}}^{2-})}$,故答案为:$\frac{{c}^{2}(O{H}^{-})}{c(W{{O}_{4}}^{2-})}$;
②根据表中温度和K之间的关系,可以看出温度高,K越大,所以反应是吸热的,故答案为:>;
(3)常温下向较浓AlCl3的溶液中不断通入HCl气体,可析出大量AlCl3•6H2O晶体,原因是AlCl3饱和溶液中存在溶解平衡:AlCl3•6H2O(s)═Al3+(aq)+3Cl-(aq)+6H2O(l),通入HCl气体,溶液中c(Cl-)增大,平衡向析出氯化铝固体的方向移动,则可析出晶体,
故答案为:AlCl3饱和溶液中存在溶解平衡:AlCl3•6H2O(s)═Al3+(aq)+3Cl-(aq)+6H2O(l),通入HCl气体使溶液中c(Cl-)增大,平衡向析出固体的方向移动从而析出AlCl3•6H2O晶体.
点评 本题考查学生化学平衡常数的有关计算、影响平衡移动的因素、沉淀溶解平衡等方面的知识,为高频考点,侧重于学生的分析、计算能力的考查,题目较为综合,难度中等,注意把握平衡常数的意义,学会分析图象.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 已知A(g)+B(g)?C(g)+D(s)反应的平衡常数与温度的关系如下:
已知A(g)+B(g)?C(g)+D(s)反应的平衡常数与温度的关系如下:| 温度℃ | 700 | 800 | 880 | 1000 | 1200 |
| 平衡常数 | 1.0 | 10.0 | 12.5 | 16.1 | 17.7 |
(1)该反应的平衡常数表达式K=$\frac{c(C)}{c(A)c(B)}$,△H>0(填“>、<、或=”);
(2)800℃时,向一个5L的密闭容器中充入0.4molA和0.7molB,若反应初始2mim内A的平均反应速率为0.01mol•L-1•min-1,则2min时c(A)=0.06mol•L-1,C的物质的量为0.1mol;若经过一段时间后,反应达到平衡时再向容器中充入0.4molA,则再次达到平衡后A的百分含量与第一次平衡相比增大(填“增大”、“减小”、或“不变”)
(3)下列选项中能作为判断反应达到平衡的依据有ad
a.压强不随时间改变
b.v(A):v(b)=1:1
c.单位时间内消耗A和B的物质的量相等
d.C的百分含量保持不变
(4)880℃时,反应 C(g)+D(s)?A(g)+B(g)的平衡常数的值为0.08.
(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),则该此时的温度为700℃.
(6)图是1000℃时容器中A的物质的量的变化曲线,请在图中补画出该反应在1200℃时A的物质的量的变化曲线图
 .
. (1)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
②已知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-169kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-157kJ•mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=+34.5kJ•mol-1.
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应每转移3mol电子,生成CuH的物质的量为1mol.
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图1.
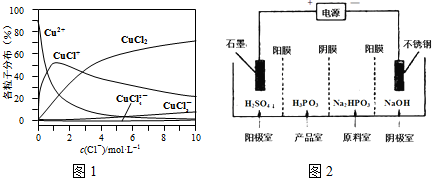
①当c(Cl-)=9mol•L-1时,溶液中主要的3种含铜物种浓度大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-).
②在c(Cl-)=1mol•L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为CuCl+═Cu2++Cl-(任写一个).
(4)已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
①在铜盐溶液中Cu2+发生水解反应的平衡常数为5×10-9;(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3/L3)
②电解Na2HPO3溶液可得到亚磷酸,装置如2图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过),则产品室中反应的离子方程式为HPO32-+2H+=H3PO3.
| A. | NaCl晶体 | B. | 液态氯化氢 | C. | 熔融的KNO3 | D. | NH3•H2O |
 周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中未成对电子有3个,C的最外层电子数为其内层电子数的3倍,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题;
周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中未成对电子有3个,C的最外层电子数为其内层电子数的3倍,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题;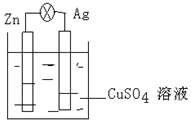 (1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,该电极上发生的电极反应式为Zn-2e-=Zn2+,银电极上发生的是还原反应(“氧化”或“还原”).
(1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,该电极上发生的电极反应式为Zn-2e-=Zn2+,银电极上发生的是还原反应(“氧化”或“还原”). .
.
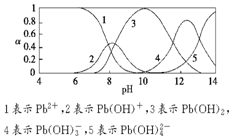 水体中重金属铅的污染问题备受关注.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(微溶)、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示.
水体中重金属铅的污染问题备受关注.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(微溶)、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示.