题目内容
7. 有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积.起始时这两个容器分别充入等量的体积比为2:1的SO2和O2的混合气,并使
有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积.起始时这两个容器分别充入等量的体积比为2:1的SO2和O2的混合气,并使A、B容器中气体体积相等,并保持在400℃条件下发生反应2SO2+O2?2SO3,并达到平衡.
(1)达到平衡所需时间,A容器比B容器短,两容器中SO2的转化率A比B大.
(2)达到(1)所述平衡后,若向两容器中分别通入等量Ar气体,A容器的化学平衡向左移动,B容器中的化学平衡不移动.
(3)达到(1)所述平衡后,若向容器中通入等量的原混合气体,重新达到平衡后,A容器中SO3的体积分数不变,B容器中SO3的体积分数增大 (填变大、变小、不变).
分析 (1)根据化学反应速率越快,到达平衡的时间越短;利用等效平衡来判断平衡移动来解答;
(2)根据容器中的压强对化学平衡的影响;
(3)根据浓度对化学平衡的影响,求出平衡移动后SO3的百分含量.
解答 解:(1)因A容器保持恒压,反应过程中体积变小,浓度增大,根据浓度越大,化学反应速率越快,到达平衡的时间越短,所以达到平衡所需时间A比B少,若A容器保持恒容,两容器建立的平衡等效,而实际上A容器体积减少,压强增大,平衡向正反应方向移动,所以A中SO2的转化率比B大,故答案为:短;大;
(2)平衡后,若向两容器通入数量不多的等量Ar,A容器体积增大,压强不变,参加反应的气体产生的压强减少,平衡向左移动,而B容器体积不变,浓度不变,平衡不移动,故答案为:向左;不;
(3)若向容器中通入等量的原混合气体,达到平衡后,A恒压中建立的平衡与原平衡等效,所以SO3的百分含量不变,B容器中建立的平衡相当于在原平衡的基础上增大压强,平衡正向移动,B容器中SO3的百分含量增大,故答案为:不变;增大.
点评 本题考查化学平衡移动的判断,题目难度较大,注意等效平衡的理解和应用,明确浓度不变反应速率不变,则平衡不移动.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
1. 如图,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则关于原来H2、O2的体积比下列正确的是( )
如图,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则关于原来H2、O2的体积比下列正确的是( )
 如图,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则关于原来H2、O2的体积比下列正确的是( )
如图,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则关于原来H2、O2的体积比下列正确的是( )| A. | 4:17 | B. | 3:7 | C. | 8:13 | D. | 7:4 |
18.某浓度的硝酸与过量铁粉反应,生成标况下一氧化二氮气体4.48L.若改用铝反应,假设只生成一氧化氮气体,则最多可溶解铝的量( )
| A. | 13.5g | B. | 9g | C. | 27g | D. | 0.33mol |
15.将浓盐酸滴入KMnO4溶液,产生黄绿色气体,溶液的紫红色褪去,向反应后的溶液中加入NaBiO3,溶液又变为紫红色,BiO3-反应后变为无色的Bi3+.据此判断下列说法正确的是( )
| A. | 滴加盐酸时,HCl是还原剂,Cl2是还原产物 | |
| B. | 已知Bi为第ⅤA族元素,上述实验说明Bi具有较强的非金属性 | |
| C. | 若有0.1 mol NaBiO3参加了反应,则整个过程转移电子0.4NA | |
| D. | 此实验条件下,物质的氧化性:KMnO4>NaBiO3>Cl2 |
12.下列有关表述正确的是( )
| A. | 位于短周期的X元素的阳离子与Y元素的阴离子具有相同的电子层结构,则两元素的原子序数一定是X<Y | |
| B. | 共价化合物的熔沸点都比较低 | |
| C. | 热稳定性:AsH3<PH3<H2O<HF | |
| D. | 最外层电子数较少的金属元素,不一定比最外层电子数较多的金属元素活泼性强 |
19.已知下列热化学方程式:Zn(s)+$\frac{1}{2}$O2( )=ZnO(s);△H=-351.1kJ/mol
Hg(l)+$\frac{1}{2}$O2(g)=HgO(s);△H=-90.7kJ/mol,
由此可知反应:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的△H为( )
Hg(l)+$\frac{1}{2}$O2(g)=HgO(s);△H=-90.7kJ/mol,
由此可知反应:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的△H为( )
| A. | △H=-1141.8kJ/mol | B. | △H=+260.4kJ/mol | ||
| C. | △H=+441.8kJ/mol | D. | △H=-260.4kJ/mol |
17.下列说法正确的是( )
| A. | 同温、同压下,相同质量的气体都占有相同的体积 | |
| B. | 同温、同压下,相同体积的气体都含有相同数目的原子 | |
| C. | 在任何情况下,1 mol CO2和64 g SO2所含有分子数和原子总数都相同 | |
| D. | 1 mol某气体的体积约为22.4 L,该气体所处的状况一定是标准状况 |
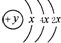 ,B、C可形成离子化合物B3C2,B离子与C离子具有相同的电子层结构,D的气态氢化物H2D的还原性较强.
,B、C可形成离子化合物B3C2,B离子与C离子具有相同的电子层结构,D的气态氢化物H2D的还原性较强.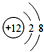 .
.