题目内容
19.已知下列热化学方程式:Zn(s)+$\frac{1}{2}$O2( )=ZnO(s);△H=-351.1kJ/molHg(l)+$\frac{1}{2}$O2(g)=HgO(s);△H=-90.7kJ/mol,
由此可知反应:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的△H为( )
| A. | △H=-1141.8kJ/mol | B. | △H=+260.4kJ/mol | ||
| C. | △H=+441.8kJ/mol | D. | △H=-260.4kJ/mol |
分析 由盖斯定律可知,反应热与反应的途径无关,只与起始状态、最终状态有关,则反应相加减时,反应热也相加减,以此来解答.
解答 解:由①Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s)△H=-351.1kJ•mol-1,
②Hg(1)+$\frac{1}{2}$O2(g)=HgO(s)△H=-90.7kJ•mol-1,
则根据盖斯定律可知,
Zn(s)+HgO(s)═ZnO(s)+Hg(1)可由①-②得到,
所以△H=(-351.1kJ•mol-1)-(-90.7kJ•mol-1)=-260.4 kJ•mol-1,
故选D.
点评 本题考查学生利用盖斯定律计算反应热,明确已知反应与目标反应的关系即可解答,题目难度不大.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
13.提纯含有少量硝酸钡杂质的硝酸钾溶液,设计实验方案为:溶液$\stackrel{过量X}{→}$ $\stackrel{过滤}{→}$ $\stackrel{除去沉淀}{→}$ $\stackrel{适量硝酸}{→}$KNO3溶液
则X 试剂为( )
则X 试剂为( )
| A. | Na2CO3 | B. | K2CO3 | C. | Na2SO4 | D. | K2SO4 |
10.下列有关SO2性质的探究实验报告记录的实验现象正确的是( )
| 实验 | 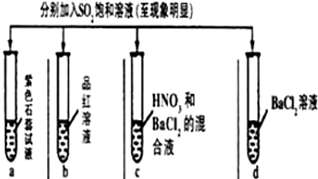 | ||||
| 记录 | A | 无色 | 无色 | 无色溶液 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 红色 | 无色 | 白色沉淀 | 无色溶液 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
14.200mL盐酸和100mL含有0.20mol碳酸钠的溶液,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
| A. | 2.0mol/L | B. | 1.5 mol/L | C. | 0.18 mol/L | D. | 0.24mol/L |
11.2010年上海世博会的主题是“城市,让生活更美好”.下列叙述中不正确的是( )
| A. | 世博会前期,处理废水时加入明矾可作为混凝剂可以为饮用水消毒 | |
| B. | 世博会期间,用二氧化硅制造的太阳能电池,节能减排 | |
| C. | 世博会中国馆--“东方之冠”使用的钢筋混凝土属于有机高分子化合物 | |
| D. | 世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 |
9.下列有机物命名正确的是( )
| A. |  2-甲基氯丙烷 2-甲基氯丙烷 | B. |  1,2,4-三甲苯 1,2,4-三甲苯 | C. |  2-甲基-1-丙醇 2-甲基-1-丙醇 | D. |  2-甲基-3-丁炔 2-甲基-3-丁炔 |
 有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积.起始时这两个容器分别充入等量的体积比为2:1的SO2和O2的混合气,并使
有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积.起始时这两个容器分别充入等量的体积比为2:1的SO2和O2的混合气,并使