题目内容
16.在100m1mol/L氯化铝溶液中,逐漓加入3mol/LNaOH溶液,请问在滴加氢氧化钠的溶液的过程中,(1)生成最大量的沉淀的质量是多少克?
(2)沉淀恰好完全消失时,消耗氢氧化钠的体积为多少毫升?
(3)若要获得3.9克沉淀,则需消耗氢氧化钠溶液的体积为多少毫升?
分析 (1)根据铝守恒分析解答;
(2)沉淀恰好完全消失时,符合AlCl3~~4NaOH,由此解答;
(3)AlCl3和NaOH反应与NaOH的量的多少有关,当NaOH不足时生成Al(OH)3,当碱过量时,则生成NaAlO2.现AlCl3的物质的量为0.1mol,完全生成Al(OH)3沉淀时,沉淀质量应为7.8g,现沉淀质量为3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2.
解答 解:(1)n[Al(OH)3]=n(AlCl3)=0.100L×1mol/L=0.1mol,所以质量为:0.1×78=7.8g,答:生成最大量的沉淀的质量是7.8g;
(2)沉淀恰好完全消失时,符合AlCl3~~4NaOH,所以n(NaOH)=4n(AlCl3)=0.4mol,所以体积为:$\frac{0.4mol}{3mol/L}$=133毫升,答:消耗氢氧化钠的体积为133毫升;
(3)现AlCl3的物质的量为0.1mol,完全生成Al(OH)3沉淀时,沉淀质量应为7.8g,现沉淀质量为3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
n(Al(OH)3)=$\frac{3.9g}{78g/mol}$=0.05mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物质的量为0.05mol×3=0.15mol,
加入NaOH溶液的体积为$\frac{0.15mol}{3mol/L}$=0.05L,即50mL;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
则由 Al3++3OH-═Al(OH)3↓
0.1mol 0.3mol 0.1mol
Al(OH)3 +OH-═AlO2-+2H2O
(0.1-0.05)mol (0.1-0.05)mol
则消耗的碱的物质的量为0.3mol+(0.1-0.05)mol=0.35mol,
加入NaOH溶液的体积为$\frac{0.35mol}{3mol/L}$=0.117L,即117mL;
答:消耗的NaOH溶液的体积是50 ml和117mL.
点评 本题考查铝的计算,题目难度中等,本题的解答关键是根据100mL1mol/L的AlCl3溶液、1mol/L的NaOH溶液,以及3.9g沉淀,结合反应的有关方程式计算.

| A. | 世博会前期,处理废水时加入明矾可作为混凝剂可以为饮用水消毒 | |
| B. | 世博会期间,用二氧化硅制造的太阳能电池,节能减排 | |
| C. | 世博会中国馆--“东方之冠”使用的钢筋混凝土属于有机高分子化合物 | |
| D. | 世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 |
 有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积.起始时这两个容器分别充入等量的体积比为2:1的SO2和O2的混合气,并使
有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积.起始时这两个容器分别充入等量的体积比为2:1的SO2和O2的混合气,并使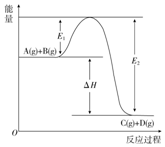 反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如图所示,回答下列问题.