题目内容
1. 如图,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则关于原来H2、O2的体积比下列正确的是( )
如图,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则关于原来H2、O2的体积比下列正确的是( )| A. | 4:17 | B. | 3:7 | C. | 8:13 | D. | 7:4 |
分析 反应前左右两室的体积之比为1.5:3.5,则左右两室中气体物质的量之比为1.5:3.5,反应后活塞处于中央,两室体积相等,则两室中气体的物质的量相等,令空气的物质的量为1.5mol,设H2、O2的物质的量分别为xmol、ymol,讨论氢气或氧气过量计算解答.
解答 解:令空气的物质的量为1.5mol,反应前左右两室的体积之比为1.5:3.5,反应前右室的物质的量为3.5mol,反应后活塞处于中央,两室体积相等,则两室中气体的物质的量相等,反应后右室气体物质的量为1.5mol,发生反应2H2+O2$\frac{\underline{\;加热\;}}{\;}$2H2O,
设H2、O2的物质的量分别为xmol、ymol,
若氢气过量,则:$\left\{\begin{array}{l}{x-2y=1.5}\\{x+y=3.5}\end{array}\right.$,解得x:y=17:4,
若氧气过量,则:$\left\{\begin{array}{l}{y-0.5x=1.5}\\{x+y=3.5}\end{array}\right.$,解得x:y=8:13,
故选:C.
点评 本题考查混合物计算,注意左室中气体物质的量不变,根据体积变化判断右室反应前后气体物质的量,再利用赋值法与讨论法计算,难度中等.

练习册系列答案
相关题目
12.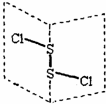 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.下列说法中错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.下列说法中错误的是( )
 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.下列说法中错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.下列说法中错误的是( )| A. | S2Cl2为含有极性键和非极性键的非极性分子 | |
| B. | 反应中SO2是氧化产物,S是还原产物 | |
| C. | S2Cl2的分子构型与H2O2的分子构型相似 | |
| D. | 反应中,生成3molS,转移电子数目为3NA |
9.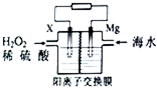 交通运输部在南海华阳礁举行华阳灯塔和赤灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用.灯塔可用镁海水电池提供能源,其装置如图所示.下列有关海水电池的说法正确的是( )
交通运输部在南海华阳礁举行华阳灯塔和赤灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用.灯塔可用镁海水电池提供能源,其装置如图所示.下列有关海水电池的说法正确的是( )
 交通运输部在南海华阳礁举行华阳灯塔和赤灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用.灯塔可用镁海水电池提供能源,其装置如图所示.下列有关海水电池的说法正确的是( )
交通运输部在南海华阳礁举行华阳灯塔和赤灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用.灯塔可用镁海水电池提供能源,其装置如图所示.下列有关海水电池的说法正确的是( )| A. | X可为铁、铜、石墨等电极,发生氧化反应 | |
| B. | 每转移2 mol电子,2molH+由交换膜左侧向右侧迁移 | |
| C. | 该电池能将化学能全部转化成电能 | |
| D. | 正极的电极反应式为比O2+2e-+2H+═2H2O |
16.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2 L水中含有分子的数目为0.5NA | |
| B. | 100 mL 0.1 mol•L-1 Na2SO4溶液中,粒子总数是0.03NA | |
| C. | 标准状况下,33.6 LHF中含有氟原子的数目为1.5NA | |
| D. | 常温常压下,7.0 gC2H4与C3H6的混合物中含有氢原子的数目为NA |
 有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积.起始时这两个容器分别充入等量的体积比为2:1的SO2和O2的混合气,并使
有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积.起始时这两个容器分别充入等量的体积比为2:1的SO2和O2的混合气,并使