题目内容
15.将浓盐酸滴入KMnO4溶液,产生黄绿色气体,溶液的紫红色褪去,向反应后的溶液中加入NaBiO3,溶液又变为紫红色,BiO3-反应后变为无色的Bi3+.据此判断下列说法正确的是( )| A. | 滴加盐酸时,HCl是还原剂,Cl2是还原产物 | |
| B. | 已知Bi为第ⅤA族元素,上述实验说明Bi具有较强的非金属性 | |
| C. | 若有0.1 mol NaBiO3参加了反应,则整个过程转移电子0.4NA | |
| D. | 此实验条件下,物质的氧化性:KMnO4>NaBiO3>Cl2 |
分析 根据题意,发生2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O、2Mn2++5BiO3-+14H+=2MnO4-+5Bi3++7H2O,结合反应中元素的化合价变化及氧化性比较规律来解答.
解答 解:根据题意,发生2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O、2Mn2++5BiO3-+14H+=2MnO4-+5Bi3++7H2O,
A.滴加盐酸时,生成氯气,Cl元素的化合价升高,则HCl是还原剂,Cl2是氧化产物,故A错误;
B.上述反应中Bi得到电子生成Bi3+,+3价较稳定,不能说明Bi单质的氧化性,则不能说明Bi具有较强的非金属性,故B错误;
C.若有0.1 mol NaBiO3参加了反应,则整个过程转移电子为0.1mol×(5-3)+0.1mol×$\frac{2}{5}$×(7-2)=0.4mol,即0.4NA,故C正确;
D.氧化剂的氧化性大于氧化产物的氧化性,则2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O中氧化性为高锰酸钾的氧化性大于氯气,2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O中NaBiO3的氧化性大于高锰酸钾,所以氧化性强弱顺序是:NaBiO3>KMnO4>Cl2,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握发生的氧化还原反应及反应中元素的化合价变化为解答的关键,注意从元素化合价角度分析,侧重规律性知识及转移电子的考查,题目难度不大.

练习册系列答案
相关题目
9.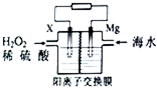 交通运输部在南海华阳礁举行华阳灯塔和赤灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用.灯塔可用镁海水电池提供能源,其装置如图所示.下列有关海水电池的说法正确的是( )
交通运输部在南海华阳礁举行华阳灯塔和赤灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用.灯塔可用镁海水电池提供能源,其装置如图所示.下列有关海水电池的说法正确的是( )
 交通运输部在南海华阳礁举行华阳灯塔和赤灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用.灯塔可用镁海水电池提供能源,其装置如图所示.下列有关海水电池的说法正确的是( )
交通运输部在南海华阳礁举行华阳灯塔和赤灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用.灯塔可用镁海水电池提供能源,其装置如图所示.下列有关海水电池的说法正确的是( )| A. | X可为铁、铜、石墨等电极,发生氧化反应 | |
| B. | 每转移2 mol电子,2molH+由交换膜左侧向右侧迁移 | |
| C. | 该电池能将化学能全部转化成电能 | |
| D. | 正极的电极反应式为比O2+2e-+2H+═2H2O |
3.下列分子中所有原子都满足最外层为8电子结构的是( )
①BeCl2 ②NCl3 ③PCl3 ④COCl2 ⑤SF6
⑥XeF2 ⑦CS2 ⑧CH4 ⑨CF2Cl2⑩S2Cl2.
①BeCl2 ②NCl3 ③PCl3 ④COCl2 ⑤SF6
⑥XeF2 ⑦CS2 ⑧CH4 ⑨CF2Cl2⑩S2Cl2.
| A. | ②④⑦⑧⑨⑩ | B. | ②③④⑦⑨⑩ | C. | ①③④⑦⑩ | D. | ③④⑤⑦⑨⑩ |
10.下列有关SO2性质的探究实验报告记录的实验现象正确的是( )
| 实验 | 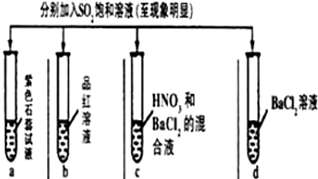 | ||||
| 记录 | A | 无色 | 无色 | 无色溶液 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 红色 | 无色 | 白色沉淀 | 无色溶液 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
20.下列应用不涉及氧化还原反应的是( )
| A. | Na2O2用作呼吸面具的供氧剂 | B. | 实验室制二氧化碳 | ||
| C. | 工业上利用合成氨实现人工固氮 | D. | 工业上电解熔融状态Al2O3制备Al |
 有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积.起始时这两个容器分别充入等量的体积比为2:1的SO2和O2的混合气,并使
有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积.起始时这两个容器分别充入等量的体积比为2:1的SO2和O2的混合气,并使