题目内容
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA | |
| C. | 50 mL 18.4 mol•L-1浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| D. | 将含有0.1 mol FeCl3的饱和溶液滴入沸水中,生成的胶体中含胶体粒子的数目为0.1NA |
分析 A、标况下HF为液体;
B、反应5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O转移15mol电子生成4mol氮气;
C、铜只能和浓硫酸反应,和稀硫酸不反应;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A、标况下HF为液体,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、反应5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O转移15mol电子生成4mol氮气,故当生成28g氮气即1mol氮气时,反应转移3.75NA个电子,故B正确;
C、铜只能和浓硫酸反应,和稀硫酸不反应,故浓硫酸不能反应完全,则生成的二氧化硫分子个数小于0.46NA个,故C错误;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故生成的胶粒的个数小于0.1NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
13.下列配制溶液的操作中,对溶液的浓度没影响的是( )
| A. | 称取碳酸钠晶体(Na2CO3•10H2O)100g来配制0.5mol/L的Na2CO3溶液1000mL | |
| B. | 配制NH3NO3溶液,在烧杯中溶解后立即注入容量瓶,并立即进行下面的各项操作 | |
| C. | 定容后,将容量瓶振荡均匀,静置时发现液面低于刻度线,于是又加入少量水至刻度线 | |
| D. | 容量瓶用蒸馏水洗净后未经干燥马上用来配制溶液 |
13.下列说法中正确的是( )
| A. | 乙烷和乙烯均可使酸性KMnO4溶液褪色 | |
| B. | 甲烷燃烧会生成CO2,因此不属于清洁能源 | |
| C. | 向甲苯中滴入少量浓溴水,振荡,静置,溶液分层,上层呈橙红色,下层几乎无色,可知甲苯和溴水发生取代反应,使溴水褪色 | |
| D. | 水煤气、裂解气、焦炉气、天然气都是混合物 |
17.根据下列实验,所得实验现象和实验结论正确的是( )
| 实验 | 现象 | 实验结论 | |
| A | 将SO2气体通入紫色石蕊试液中 | 溶液先变红后褪色 | 二氧化硫具有酸性和漂白性 |
| B | 将小苏打和硫酸应生成的气体,通入一定浓度的Na2SiO3溶液中 | 出现白色胶状沉淀 | 酸性:H2SO4>H2CO3>H2SiO3 |
| C | 将光亮的镁条放入盛有NH4Cl溶液的试管中 | 有大量气泡产生 | 反应中有NH3产生 |
| D | 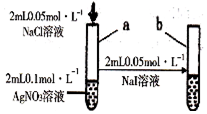 | 试管a出现白色沉淀,试管b出现黄色沉淀 | 溶度积:Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
14.甲苯中混有少量苯酚,除去苯酚的最佳方法是( )
| A. | 加入足量的NaOH溶液充分振荡后,用分液漏斗分液弃除下层溶液 | |
| B. | 加入溴水,生成三溴苯酚,再过滤除去 | |
| C. | 加水,加热超过 70℃(苯酚在热水中溶解度很大),然后用分液漏斗振荡分液后,弃除下层溶液 | |
| D. | 将混合物蒸馏(甲苯沸点110℃,苯酚沸点182℃),可先蒸出甲苯 |
11.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A. | 在0.1mol•L-1 Na2SO3溶液溶液中:c(Na+)═2c(SO32-)+c(HSO3-)+c(H2SO3) | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)-c(H+)═c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CaCl2混合溶液中:c(Na+)+c(Ca2+)═c(CH3COOH)+c(CH3COO-)+2 c(Cl-) |
12.化学与生活密切相关,下列说法不正确的是( )
| A. | 高价铁盐可用于硬水的软化 | |
| B. | 钾、钠、镁等活泼金属着火时.不能用泡沫灭火器灭火 | |
| C. | 生产水泥和玻璃均可用到碳酸钙 | |
| D. | 石英砂可用干生产粗硅 |