题目内容
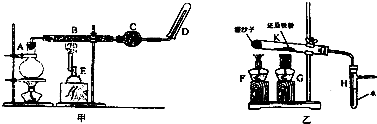
7.铁元素在人类生活中扮演着非常重要的角色,不仅仅是重要的建筑材料,也是人体必须的微量元素.每年钢铁的腐蚀带来巨大的经济损失.某校研究小组在实验室中模拟钢铁在自然环境下的腐蚀,设置如图装置(图A-C),几天后观察结果: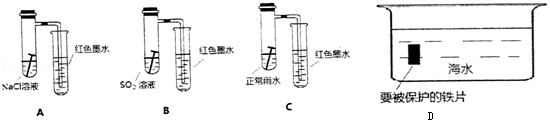
请回答下列问题:
(1)请比较以上三个装置中右侧导管中红墨水的高度由高到低的顺序为:A>C>B.请写出A装置中,钢铁锈蚀时正极反应的电极反应式O2+4e-+2H2O=4OH-.
(2)钢铁的防腐有重大的意义,生活中常将金属制品放在干燥处或者涂上矿物油予以保护.若将图D中铁片上镶嵌锌片以保护铁不被腐蚀,利用的是原电池原理(填“原电池”或“电解池”).
分析 (1)强酸性条件下,铁发生析氢腐蚀,中性或弱酸性条件下,铁发生吸氧腐蚀,A装置溶液呈中性,铁发生吸氧腐蚀,正极上氧气得电子发生还原反应;
(2)为防止金属铁被腐蚀,可利用牺牲阳极的阴极保护法保护金属,由于还原性Zn>Fe,故在船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率.
解答 解:(1)强酸性条件下,铁发生析氢腐蚀,中性或弱酸性条件下,铁发生吸氧腐蚀,A装置溶液呈中性,铁发生吸氧腐蚀,B、C溶液呈酸性,铁发生析氢腐蚀,但B中酸性较强,所以铁发生腐蚀严重,发生吸氧腐蚀时左边试管中压强减小,右边导管中红墨水上升,B、C右边导管中红墨水下降,且B下降比C多,所以右侧导管中红墨水高度:A>C>B;
A中铁发生吸氧腐蚀,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,
故答案为:A>C>B;O2+4e-+2H2O=4OH-;
(2)碳、铁和海水构成的原电池中,铁失电子作负极,所以负极上电极反应式为:Fe-2e-=Fe2+,为防止金属被腐蚀,可利用牺牲阳极的阴极保护法保护金属,让船体的钢板作原电池正极,选取比铁活泼的金属,如锌作原电池负极,从而能够保护船体,减缓船体被海水腐蚀的速率,
故答案为:原电池.
点评 本题考查金属腐蚀与防护,明确原电池原理的原理即可解答,知道钢铁发生析氢腐蚀和吸氧腐蚀的条件、区别,知道防止金属被腐蚀的方法,题目难度不大.

练习册系列答案
相关题目
18.下列分离或提纯有机物的方法正确的是( )
| 选项 | 待提纯物质 | 杂质 | 除杂试剂及主要操作方法 |
| A | 乙烷 | 乙烯 | 酸性KMnO4溶液,洗气 |
| B | 溴苯 | 溴 | NaOH溶液,分液 |
| C | 乙酸 | 乙醇 | 金属钠,蒸馏 |
| D | 乙醇 | 水 | 生石灰,过滤 |
| A. | A | B. | B | C. | C | D. | D |
18.下列叙述错误的是( )
| A. | 10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49% | |
| B. | 地球上99%的溴蕴藏在大海中,故溴被称为“海洋元素” | |
| C. | 在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水 | |
| D. | 向两等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变) |
15.下列说法正确的是( )
| A. | 由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定 | |
| B. | 500℃、30M Pa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 已知热化学方程式:2SO2(g)+O2?(g) 2SO3(g)△H=-Q kJ/mol,若将一定量的SO2(g)和O2(g)置于密闭容器中充分反应后放出热量Q kJ,则此过程中有2 mol SO2(g)被氧化 | |
| D. | X(g)+Y(g)?Z(g)△H>0,恒温恒容条件下达到平衡后加入X,上述反应△H增大 |
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA | |
| C. | 50 mL 18.4 mol•L-1浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| D. | 将含有0.1 mol FeCl3的饱和溶液滴入沸水中,生成的胶体中含胶体粒子的数目为0.1NA |
12. 室温下,将0.10mol•L-1的盐酸滴入20mL0.10mol•L-1的氨水中,溶液的pH和pOH随加入盐酸体积变化的曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )
室温下,将0.10mol•L-1的盐酸滴入20mL0.10mol•L-1的氨水中,溶液的pH和pOH随加入盐酸体积变化的曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )
 室温下,将0.10mol•L-1的盐酸滴入20mL0.10mol•L-1的氨水中,溶液的pH和pOH随加入盐酸体积变化的曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )
室温下,将0.10mol•L-1的盐酸滴入20mL0.10mol•L-1的氨水中,溶液的pH和pOH随加入盐酸体积变化的曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )| A. | M点所示的溶液中c(NH4+)+c(NH3•H2O)=c(Cl-) | |
| B. | Q点所示的溶液中c(NH4+)>c(Cl-)>c(H+)=c(OH-) | |
| C. | N点所示的溶液中c(NH4+)=c(Cl-) | |
| D. | M点和N点所示的溶液中水的电离程度相同 |
19.NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如图:
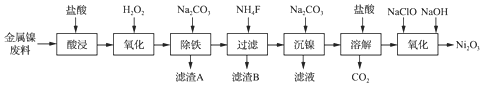
流程中相关金属离子生成氢氧化物沉淀的pH如表所示:
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③增大盐酸的浓度(或将镍废料研成粉末或延长浸泡时间等)等.
(2)加入H2O2时发生主要反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)“除铁”时,控制溶液pH的范围为3.2~7.1.
(4)滤渣B的主要成分的化学式为MgF2、CaF2.
(5)已知:Ksp(NiCO3)=1.42×10-7.为确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),应保持溶液中c(CO32-)>0.142mol•L-1.
(6)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-═Ni2O3↓+Cl-+2H2O.

流程中相关金属离子生成氢氧化物沉淀的pH如表所示:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(2)加入H2O2时发生主要反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)“除铁”时,控制溶液pH的范围为3.2~7.1.
(4)滤渣B的主要成分的化学式为MgF2、CaF2.
(5)已知:Ksp(NiCO3)=1.42×10-7.为确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),应保持溶液中c(CO32-)>0.142mol•L-1.
(6)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-═Ni2O3↓+Cl-+2H2O.
16.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A. | H+、NO3-、Fe2+、Na+ | B. | Ag+、K+、I-、Cl- | ||
| C. | K+、Ba2+、OH-、SO42- | D. | K+、Cu2+、Br-、OH- |