题目内容
11.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )| A. | 在0.1mol•L-1 Na2SO3溶液溶液中:c(Na+)═2c(SO32-)+c(HSO3-)+c(H2SO3) | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)-c(H+)═c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CaCl2混合溶液中:c(Na+)+c(Ca2+)═c(CH3COOH)+c(CH3COO-)+2 c(Cl-) |
分析 A.在0.1mol•L-1 Na2SO3溶液溶液中存在物料守恒,n(Na)=2n(S);
B.在0.1 mol•L-1Na2CO3溶液中存在质子守恒,水电离出氢氧根等所有氢离子存在形式;
C.向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液得到等浓度的Na2CO3溶液和NaHCO3溶液,碳酸根路致震水解大于碳酸氢根离子;
D.常温下,CH3COONa和CaCl2混合溶液中氯化钙和醋酸钠的物质的量不知,c(Na+)、c(Ca2+)离子浓度不一定是1:1,溶液中存在电荷守恒.
解答 解:A.在0.1mol•L-1 Na2SO3溶液溶液中存在物料守恒,n(Na)=2n(S),c(Na+)═2c(SO32-)+2c(HSO3-)+2c(H2SO3),故A错误;
B.在0.1 mol•L-1Na2CO3溶液中存在质子守恒:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),得到c(OH-)-c(H+)═c(HCO3-)+2c(H2CO3),故B正确;
C.向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液得到等浓度的Na2CO3溶液和NaHCO3溶液,溶液中c(CO32-)<c(HCO3-),故C错误;
D.常温下,CH3COONa和CaCl2混合溶液中:c(Na+)═c(CH3COOH)+c(CH3COO-),c(Ca2+)═2 c(Cl-),c(Na+)、c(Ca2+)离子浓度不一定是1:1,故D错误;
故选B.
点评 本题考查了电解质溶液中电荷守恒、物料守恒、质子守恒、离子浓度大小等,准确理解离子性质、离子电离、离子水解是解题关键,题目难度中等.

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA | |
| C. | 50 mL 18.4 mol•L-1浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| D. | 将含有0.1 mol FeCl3的饱和溶液滴入沸水中,生成的胶体中含胶体粒子的数目为0.1NA |
19.NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如图:
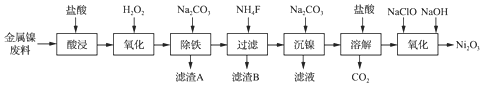
流程中相关金属离子生成氢氧化物沉淀的pH如表所示:
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③增大盐酸的浓度(或将镍废料研成粉末或延长浸泡时间等)等.
(2)加入H2O2时发生主要反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)“除铁”时,控制溶液pH的范围为3.2~7.1.
(4)滤渣B的主要成分的化学式为MgF2、CaF2.
(5)已知:Ksp(NiCO3)=1.42×10-7.为确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),应保持溶液中c(CO32-)>0.142mol•L-1.
(6)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-═Ni2O3↓+Cl-+2H2O.

流程中相关金属离子生成氢氧化物沉淀的pH如表所示:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(2)加入H2O2时发生主要反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)“除铁”时,控制溶液pH的范围为3.2~7.1.
(4)滤渣B的主要成分的化学式为MgF2、CaF2.
(5)已知:Ksp(NiCO3)=1.42×10-7.为确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),应保持溶液中c(CO32-)>0.142mol•L-1.
(6)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-═Ni2O3↓+Cl-+2H2O.
16.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A. | H+、NO3-、Fe2+、Na+ | B. | Ag+、K+、I-、Cl- | ||
| C. | K+、Ba2+、OH-、SO42- | D. | K+、Cu2+、Br-、OH- |
3.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 6.4gO2和O3的混合气体,含氧原子数为0.4NA | |
| B. | 分子标准状况下,11.2LCCl4中含分子数为0.5NA | |
| C. | 1mol乙酸(忽视挥发损失)与足量的C2H518OH在浓硫酸作用下加热,充分反应可生成NA个CH3CO18OC2H5 | |
| D. | 常温常压下,7.8gNa2O2含离子数为0.4NA |
20.表是元素周期表的一部分,针对表中的①-⑧八种元素,用元素符号或化学式回答相关问题:
(l)在这些元素中,化学性质最不活泼原子的原子结构示意图为 .
.
(2)用电子式表示①与③形成化合物的过程 .
.
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,②、④的最高价氧化物对应水化物的溶液反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(4)①②③④四种元素的简单离子半径由大到小的顺序是F->Na+>Mg2+>Al3+.(用离子符号和“>”表示).
(5)①⑤⑧三种元素的单质沸点由高到低的顺序是Br2>Cl2>F2.(用化学式和“>”表示).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | |||||||
| 三 | ② | ③ | ④ | ⑤ | ⑥ | |||
| 四 | ⑦ | ⑧ |
 .
.(2)用电子式表示①与③形成化合物的过程
 .
.(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,②、④的最高价氧化物对应水化物的溶液反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(4)①②③④四种元素的简单离子半径由大到小的顺序是F->Na+>Mg2+>Al3+.(用离子符号和“>”表示).
(5)①⑤⑧三种元素的单质沸点由高到低的顺序是Br2>Cl2>F2.(用化学式和“>”表示).
8.FeS2与HNO3反应后的氧化产物为Fe(NO3)3和H2SO4,若反应中FeS2与HNO3的物质的量之比为1:8,则HNO3的还原产物为( )
| A. | NO2 | B. | NO | C. | N2O | D. | N2O3 |
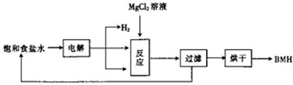 BMH{碱式次氯酸镁}[Mg2ClO(OH)n•H2O]}是一种白色粉末.难溶于水,是常用的无机抗菌剂,其一种生产工艺如图所示.
BMH{碱式次氯酸镁}[Mg2ClO(OH)n•H2O]}是一种白色粉末.难溶于水,是常用的无机抗菌剂,其一种生产工艺如图所示.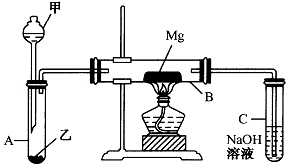 已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.